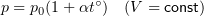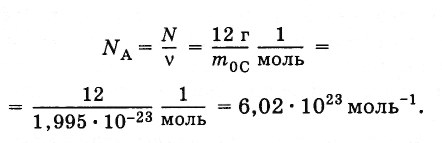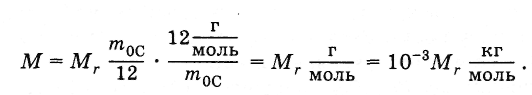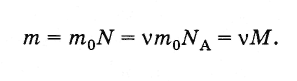Основные положения МКТ. Масса и размер молекул. Количество вещества. Молекулярная физика
- Подробности
- Обновлено 07.10.2018 21:04
- Просмотров: 1193
МКТ — это просто!
«Ничто не существует, кроме атомов и пустого пространства …» — Демокрит
«Любое тело может делиться до бесконечности» — Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ — это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела — это большие тела, состоящие из огромного числа молекул.
Тепловые явления — явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
— механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
— диффузия; броуновское движение частиц в жидкости под ударами молекул;
— плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
— фотографирование, определение размеров частиц.
Броуновское движение
Броуновское движение — это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
— открыто английским ботаником Р. Броуном в 1827 г.
— дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
— экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около см.
Число молекул в веществе
где V — объем вещества, Vo — объем одной молекулы
Масса одной молекулы
где m — масса вещества,
N — число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м. :
Относительная молекулярная масса вещества
Для удобства расчетов вводится величина — относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
где числитель — это масса молекулы, а знаменатель — 1/12 массы атома углерода
— это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента
где числитель — это масса атома, а знаменатель — 1/12 массы атома углерода
— величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества
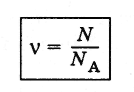
Количество вещества (ν) определяет относительное число молекул в теле.
где N — число молекул в теле, а Na — постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль — это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:
Молярная масса
Молярная масса (M) — это масса вещества, взятого в одном моле, или иначе — это масса одного моля вещества.
где
— масса молекулы
— постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества
и формула для 7 класса
Количество вещества
Число молекул в веществе
Молярная масса
Масса одной молекулы
Связь между относительной молекулярной массой и молярной массой
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. —
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. —
Идеальный газ. Основное уравнение МКТ. —
Температура. Тепловое равновесие. Абсолютная шкала температур. —
Уравнение состояния идеального газа. —
Изопроцессы. Газовые законы. —
Взаимные превращения жидкостей и газов. Влажность воздуха. —
Твердые тела. Кристаллические тела. Аморфные тела.
Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.
Количество вещества
Чем больше атомов
или молекул в макроскопическом теле,
тем, очевидно, больше вещества содержится
в нем. Число молекул в макроскопических
телах огромно. Поэтому удобно указывать
не абсолютное число атомов, а относительное.
Принято
сравнивать число молекул или атомов в
данном теле с числом атомов, содержащихся
в углероде массой 12 г. Относительное
число атомов или молекул в теле
характеризуется особой физической
величиной, называемой количеством
вещества.
Количеством
вещества v
называют отношение числа молекул N
в
данном теле к числу атомов NA
в
12 г углерода*.
(2.2.2)
* Если вещество
состоит из отдельных атомов, не
объединенных в молекулы, то здесь и в
дальнейшем под числом молекул надо
подразумевать число атомов.
Зная
количество вещества v
и число NA,
мы
тем самым знаем число молекул N
в
веществе. Количество вещества выражают
в молях.
Моль
— это количество вещества, содержащего
столько же молекул, сколько атомов
содержится в углероде массой 12 г.
Если
количество вещества равно, например,
2,5 моль, то это означает, что число молекул
в теле в 2,5 раза превышает число атомов
в 12 г углерода, т. е. равно 2,5
NA.
Постоянная Авогадро
Число
молекул или атомов в моле вещества
называют постоянной Авогадро. Это
название дано в честь итальянского
ученого XIX
в. А. Авогадро**.
** А. Авогадро
(1776—1856) — итальянский физик и химик;
автор четырехтомного труда, который
был первым руководством по молекулярной
физике.
Согласно определению
моля постоянная Авогадро одинакова для
всех веществ. Она равна, в частности,
числу атомов в моле углерода, т. е. в 12 г
углерода.
Для
вычисления постоянной Авогадро надо
найти массу одного атома углерода (или
любого другого атома). Грубую оценку
массы можно сделать так, как это было
выполнено для массы молекулы воды.
Наиболее точные методы определения
массы основаны на отклонении пучков
ионов электромагнитным полем. Измерения
дают для массы атома углерода т0С
=
1,995·10-23
г. Отсюда постоянная Авогадро равна
(2.2.3)
Наименование
моль-1
указывает, что NA
—
число атомов любого вещества, взятого
в количестве одного моля. Если количество
вещества v
= 2,5 моль, то число молекул в теле N
= vNA
= 1,5·1024.
Существует много
других методов определения постоянной
Авогадро, не связанных с нахождением
масс атомов. Все они приводят к одним и
тем же результатам. Постоянная Авогадро
играет важнейшую роль во всей молекулярной
физике и является универсальной
постоянной.
Огромная величина
постоянной Авогадро показывает, насколько
малы микроскопические масштабы по
сравнению с макроскопическими. Тело,
обладающее количеством вещества 1 моль,
имеет привычные для нас макроскопические
размеры.
Молярная масса
Наряду
с относительной молекулярной массой
Мr,
в
физике и химии широко используется
понятие молярной массы М.
Молярной
массой называют массу
вещества,
взятого в количестве одного моля.
Согласно этому
определению молярная масса равна
произведению массы молекулы на постоянную
Авогадро:

(2.2.4)
Молярная
масса простым образом связана с
относительной молекулярной массой.
Подставив в формулу (2.2.4) выражения т0
из
(2.2.2) и NA
из
(2.2.3), получим:
(2.2.5)
Например,
молярная масса воды Н2О
равна 18 г/моль, или 0,18 кг/моль, так как
относительная молекулярная масса воды
приближенно равна 18.
Масса
m
произвольного
количества вещества v
и молярная масса М
связаны
соотношением:
(2.2.6)
Так,
масса 3 моль воды равна: m
= 3
моль·0,018 кг/моль = 0,054 кг.
Используя
формулы (2.2.6) и (2.2.2), можно получить
формулу для числа молекул в теле в
зависимости от массы тела m
и
молярной массы М:
(2.2.7)
Нужно
запомнить значение постоянной Авогадро:
достаточно знать порядок величины 1023.
Столько
молекул содержится в
12 г углерода,
в
18 г воды
и т. д. Формулы (2.2.1),
(2.2.2) и
(2.2.4)
дают
определения новым физическим величинам:
относительной молекулярной массе,
количеству вещества и молярной массе.
Вывести их нельзя, их надо просто
запомнить. Остальные формулы можно
вывести, и запоминать их необязательно.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Недавно
мы говорили о размерах молекул и выяснили, что они очень малы. Как вы
понимаете, измерять массу молекул в обычных единицах массы, таких как
килограммы или граммы, крайне неудобно. Поэтому люди придумали относительную
молекулярную массу. Относительная молекулярная (или атомная) масса вещества —
это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Дело
в том, что углерод входит в множество веществ, и по международному соглашению
было решено использовать углеродную шкалу атомных масс. Нетрудно догадаться,
что относительная молекулярная масса — это безразмерная величина, поскольку
она показывает во сколько раз масса данной молекулы (или атома) больше массы
одной двенадцатой атома углерода. Тем не менее, молекулярную массу
условились измерять в атомных единицах массы (а. е. м.).
Относительные
массы всех химических элементов измерены с высокой точностью, и их можно найти
в таблице Менделеева.
Например,
относительная атомная масса водорода равна 1, относительная атомная масса гелия
равна 4 и так далее.
Зная
атомные массы можно вычислить и молекулярную массу. Например, относительная
молекулярная масса соляной кислоты равна
Аналогичным
способом можно вычислить массы других молекул. Например, молекула серной кислоты
состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Таким образом, относительная молекулярная масса серной кислоты равна .
Еще
одно понятие, с которым необходимо ознакомиться при изучении
молекулярно-кинетической теории — это количество вещества. Можно,
конечно, определить количество вещества, как количество молекул, содержащихся в
данном теле. Но, как мы уже убедились, это количество просто огромно для любого
макроскопического тела, поэтому нам снова нужно ввести специальную величину.
Эта величина так и называется «количество вещества» и обозначается буквой ν.
Единицей измерения количества вещества является моль: .
1
моль — это количество вещества, в котором содержится столько же молекул или
атомов, сколько содержится атомов в 12 г углерода.
Это
число было определено Амедео Авогадро еще в 19 веке. Один моль любого вещества
содержит 6,02 х 1023 молекул. Это число называется числом
Авогадро или постоянной Авогадро.
Таким
образом, зная число молекул в теле, можно определить количество вещества:
С
постоянной Авогадро связана и другая величина, которая называется молярной
массой — это масса данного вещества, взятого в количестве 1 моль.
Исходя
из этого, можно заключить, что молярная масса вещества равна .
Как
видно из этого уравнения, молярная масса измеряется .
Заметим, что массу любого вещества можно представить, как произведение массы
молекулы этого вещества и количества молекул, содержащегося в данном веществе:
Тогда
можно записать:
Необходимо
отметить, что молярную массу можно также взять из таблицы Менделеева, как и
молекулярную массу. Они численно равны, но следует понимать, что они обозначают
различные величины, а потому измеряются в различных единицах измерения. В
таблице Менделеева молярная масса указана в г/моль, поэтому нельзя забывать
переводить её в кг/моль при решении задач по физике.
Пример
решения задачи.
Задача
1. Определите
массу 3 моль углекислого газа.
Формулы молекулярной физики
Формула концентрации молекул
Здесь n — концентрация 

Формула плотности
Здесь 


Формула относительной молекулярной массы
Здесь 


Формула количества вещества (количества молей)
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
Здесь 




Формулы количества молекул
Здесь A — количество молекул (безразмерное), п — концентрация молекул 




Формулы средней квадратичной скорости молекул
Здесь 


Основное уравнение кинетической теории идеального газа
Здесь р — давление газа (Па), 



Формула средней кинетической энергии молекул
Здесь 


Связь шкал Цельсия и Кельвина
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
Здесь 
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
Здесь р — давление газа (Па), V — объем 


Объединенный газовый закон — уравнение Клапейрона
при
Здесь 



Закон Бойля — Мариотта (изотермический процесс)
при
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 



Закон Гей-Люссака (изобарный процесс)
при
Здесь р — давление газа (Па), m — масса газа (кг), 




Закон Шарля
при
Здесь V — объем газа 


Связь давления идеального газа с концентрацией его молекул и температурой
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа 
Формулы относительной влажности
Здесь 



Работа при изобарном изменении объема газа
Здесь А — работа (Дж), р — давление газа (Па), 


Внутренняя энергия идеального одноатомного газа
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 

Первый закон термодинамики
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при
к изохорному: при V = const
к изобарному: при р = const
к адиабатному: при Q = 0
Здесь Т — абсолютная температура (К), 

Формулы количества теплоты при нагревании или охлаждении тел
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 





Формула количества теплоты при плавлении или кристаллизации
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 
Формула количества теплоты при парообразовании или конденсации
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
Здесь 



Коэффициент полезного действия идеального теплового двигателя
Здесь 


Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Задачи по физике с решением
Возможно вам будут полезны эти страницы: