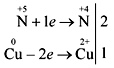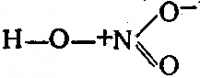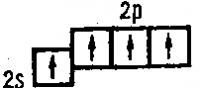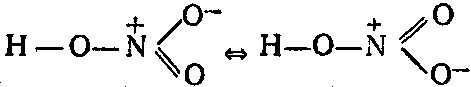Азотная кислота: свойства и реакции,
лежащие в основе производства
9 класс
Приходя на урок химии, ребята хотят узнать
новое и применить свои знания, особенно им
нравится самостоятельно добывать информацию и
экспериментировать. Данный урок построен так,
чтобы, изучая новый материал, учащиеся могли
привлечь ранее приобретенные знания: строение
атома азота, типы химической связи,
электролитическая диссоциация,
окислительно-восстановительные реакции, техника
безопасности при проведении эксперимента.
Цели. Повторить классификацию и свойства
оксидов азота, а также общие свойства азотной
кислоты в свете теории электролитической
диссоциации (ТЭД). Познакомить учащихся с
окислительными свойствами азотной кислоты на
примере взаимодействия разбавленной и
концентрированной кислоты с металлами. Дать
понятие о способах получения азотной кислоты и
областях ее применения.
Оборудование. На каждом столе перед
учащимися план урока, схема взаимодействия
азотной кислоты с металлами, набор реактивов,
тесты для закрепления изученного материала.
П л а н у р о к а
• Оксиды азота.
• Состав и строение молекулы азотной кислоты.
• Физические свойства азотной кислоты.
• Химические свойства азотной кислоты.
• Получение азотной кислоты.
• Применение азотной кислоты.
• Закрепление материала (тест по вариантам).
ХОД УРОКА
Оксиды
азота
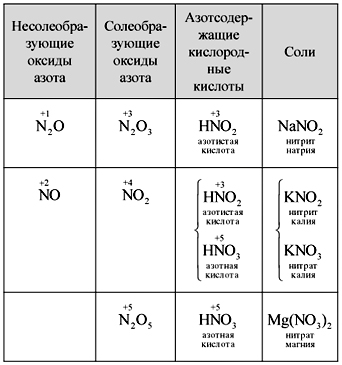
Учитель. Вспомните и напишите
формулы оксидов азота. Какие оксиды называются
солеобразующими, какие – несолеобразующими?
Почему?
Ученики самостоятельно записывают формулы
пяти оксидов азота, называют их, вспоминают
азотсодержащие кислородные кислоты и
устанавливают соответствие между оксидами и
кислотами. Один из учеников записывает на доске
(таблица).
Таблица
Сопоставление оксидов азота, кислот и
солей
Демонстрационный опыт:
взаимодействие оксида азота(IV) с водой
Учитель. В сосуд с NO2
приливаем немного воды и взбалтываем содержимое,
затем испытываем полученный раствор лакмусом.
Что наблюдаем? Раствор краснеет из-за
образовавшихся двух кислот.
2NO2 + H2O = HNO2 + HNO3.
Степень окисления азота в NO2 равна +4,
т.е. она является промежуточной между +3 и +5,
которые в растворе более устойчивы, поэтому
оксиду азота(IV) соответствуют сразу две кислоты
– азотистая и азотная.
Состав и
строение молекулы
Учитель. На доске запишите
молекулярную формулу азотной кислоты, вычислите
ее молекулярную массу и отметьте степени
окисления элементов. Составьте структурную и
электронную формулы.
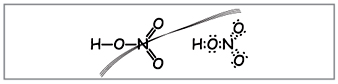
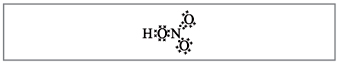
Ученики составляют следующие формулы (рис. 1).
Рис. 1. Неверные структурная и
электронная формулы азотной кислоты
Учитель. Согласно этим формулам
вокруг азота вращается десять электронов, но
этого не может быть, т.к. азот находится во втором
периоде и максимально на внешнем слое у него
может быть только восемь электронов. Это
противоречие устраняется, если предположить, что
между атомом азота и одним из атомов кислорода
образуется ковалентная связь по
донорно-акцепторному механизму (рис. 2).
Рис. 2. Электронная формула азотной
кислоты.
Электроны атома азота обозначены черными
точками
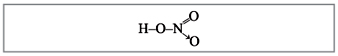
Тогда структурную формулу азотной кислоты
можно было бы изобразить так (рис. 3):
Рис. 3. Структурная формула азотной
кислоты
(донорно-акцепторная связь показана стрелкой)
Однако опытным путем доказано, что двойная
связь равномерно распределена между двумя
атомами кислорода. Степень окисления азота в
азотной кислоте равна +5, а валентность (обратите
внимание) равна четырем, ибо имеются только
четыре общие электронные пары.
Физические
свойства азотной кислоты
Учитель. Перед вами флаконы с
разбавленной и концентрированной азотной
кислотой. Опишите физические свойства, которые
вы наблюдаете.
Ученики описывают азотную кислоту как жидкость
тяжелее воды, желтоватого цвета, с резким
запахом. Раствор азотной кислоты без цвета и без
запаха.
Учитель. Я добавлю, что температура
кипения азотной кислоты +83 °С, температура
замерзания –41 °С, т.е. при обычных условиях это
жидкость. Резкий запах и то, что при хранении она
желтеет, объясняется тем, что концентрированная
кислота малоустойчива и под действием света или
при нагревании частично разлагается.
Химические
свойства кислоты
Учитель. Вспомните, с какими
веществами взаимодействуют кислоты? (Учащиеся
называют.)
Перед вами реактивы, проделайте
перечисленные реакции* и
запишите свои наблюдения (реакции записывать
надо в свете ТЭД).
А теперь обратимся к специфическим свойствам
азотной кислоты.
Мы отметили, что кислота при хранении желтеет,
теперь докажем это химической реакцией:
4HNO3 = 2H2O + 4NO2 + O2.
(Учащиеся самостоятельно записывают
электронный баланс реакции.)
Выделяющийся «бурый газ» (NO2) окрашивает
кислоту.
Особо ведет себя эта кислота по отношению к
металлам. Вы знаете, что металлы вытесняют
водород из растворов кислот, но при
взаимодействии с азотной кислотой этого не
происходит.
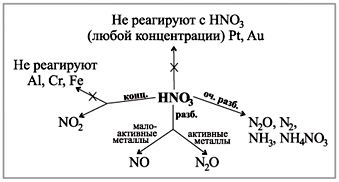
Посмотрите на схему у вас на парте (рис. 4), где
показано, какие газы выделяются при реакции
кислоты различной концентрации с металлами.
(Работа со схемой.)
Рис. 4. Схема взаимодействия азотной
кислоты с металлами
Демонстрационный опыт:
взаимодействие концентрированной азотной
кислоты с медью
Очень эффективна демонстрация реакции азотной
кислоты (конц.) с порошком меди или мелко
нарезанными кусочками медной проволоки:
Учащиеся самостоятельно записывают
электронный баланс реакции:
Получение
кислоты
Учитель. Урок будет неполным, если мы
не рассмотрим вопрос получения азотной кислоты.
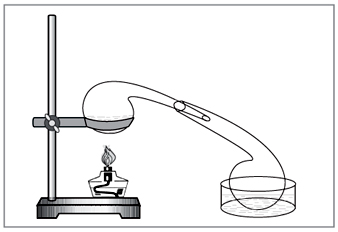
Лабораторный способ: действие
концентрированной серной кислоты на нитраты
(рис. 5).
NaNO3 + H2SO4 = NaHSO4 + HNO3.
В промышленности кислоту в основном получают
аммиачным способом.
Рис. 5. Для получения азотной кислоты в
лаборатории до сих пор
удобно использовать старинную химическую посуду
– реторту
Способ получения кислоты из азота и кислорода
при температуре свыше 2000 °С (электродуговой)
особого распространения не получил.
В России история получения азотной кислоты
связана с именем химика-технолога Ивана
Ивановича Андреева (1880–1919).
Он в 1915 г. создал первую установку по
производству кислоты из аммиака и реализовал
разработанный способ в заводском масштабе в
1917 г. Первый завод был построен в Донецке.
Этот метод включает несколько этапов.
1) Подготовка аммиачно-воздушной смеси.
2) Окисление аммиака кислородом воздуха на
платиновой сетке:
4NH3 + 5O2 = 4NO + 6H2O.
3) Дальнейшее окисление оксида азота(II) до
оксида азота(IV):
2NO + O2 = 2NO2.
4) Растворение оксида азота(IV) в воде и
получение кислоты:
3NO2 + H2O = 2HNO3 + NO.
Если растворение проводить в присутствии
кислорода, то весь оксид азота(IV) переходит в
азотную кислоту.
5) Заключительный этап получения азотной
кислоты – очистка газов, выходящих в атмосферу,
от оксидов азота. Состав этих газов: до 98% азота,
2–5% кислорода и 0,02–0,15% оксидов азота. (Азот
изначально был в воздухе, взятом для окисления
аммиака.) Если оксидов азота в этих отходящих
газах больше 0,02%, то специально проводят
каталитическое восстановление их до азота,
потому что даже такие малые количества этих
оксидов приводят к большим экологическим
проблемам.
После всего сказанного возникает вопрос: а
зачем нам нужна кислота?
Применение
кислоты
Учитель. Азотную кислоту используют
для производства: азотных удобрений, и в первую
очередь аммиачной селитры (как ее получают?);
взрывчатых веществ (почему?); красителей;
нитратов, о которых речь пойдет на следующем
уроке.
Закрепление
материала
Фронтальный опрос класса
– Почему степень окисления азота в азотной
кислоте +5, а валентность четыре?
– С какими металлами азотная кислота не
вступает в реакцию?
– Вам нужно распознать соляную и азотную
кислоты, на столе три металла – медь, алюминий и
железо. Как вы поступите и почему?
Тест
В а р и а н т 1
1. Какой ряд чисел соответствует
распределению электронов по энергетическим
уровням в атоме азота?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Закончите уравнения практически
осуществимых реакций:
1) HNO3 (разб.) + Cu … ;
2) Zn + HNO3 (конц.) … ;
3) HNO3 + MgCO3 …
;
4) CuO + KNO3 … .
3. Укажите, какое уравнение иллюстрирует
одну из стадий процесса промышленного
производства азотной кислоты.
1) 4NH3 + 5O2 = 4NO + 6H2O;
2) 5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO;
3) N2 + O2 = 2NO.
4. Отрицательная степень окисления
проявляется азотом в соединении:
1) N2O; 2) NO; 3) NO2; 4) Na3N.
5. Взаимодействие медной стружки с
концентрированной азотной кислотой приводит к
образованию:
1) NO2; 2) NO; 3) N2; 4) NH3.
В а р и а н т 2
1. Значение высшей валентности азота равно:
1) 1; 2) 2; 3) 5; 4) 4.
2. Запишите возможное взаимодействие
концентрированной азотной кислоты со следующими
металлами: натрий, алюминий, цинк, железо, хром.
3. Выберите вещества, являющиеся сырьем для
производства азотной кислоты:
1) азот и водород;
2) аммиак, воздух и вода;
3) нитраты.
4. Концентрированная азотная кислота не
реагирует с:
1) углекислым газом;
2) соляной кислотой;
3) углеродом;
4) гидроксидом бария.
5. При взаимодействии очень разбавленной
кислоты с магнием образуется:
1) NO2; 2) NO; 3) N2O; 4) NH4NO3.
Ответы на тесты
В а р и а н т 1.
1 – 4;
2.
1) 8HNO3 (разб.) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O;
2) Zn + 4HNO3 (конц.) = Zn(NO3)2 + 2NO2
+ 2H2O;3) 2HNO3 + MgCO3 = Mg(NO3)2 + CO2
+ H2O;
3 – 1; 4 – 4; 5 – 1.
В а р и а н т 2.
1 – 4;
2.
Na + 2HNO3 (конц.) = NaNO3 + NO2 + H2O,
Zn + 4HNO3 (конц.) = Zn(NO3)2 + 2NO2 +
2H2O;
3 – 2; 4 – 1; 5 – 4.
Домашнее задание.
Прочитать по учебнику «Химия-9» (Рудзитис Г.Е.,
Фельдман Ф.Г. М.: Просвещение, 2002) § 21, повторить
конспект урока и схему взаимодействия кислоты с
металлами.
* Например, можно предложить
ребятам проделать следующие лабораторные опыты.
1) В пробирку с раствором азотной кислоты
добавьте лакмус и постепенно добавляйте раствор
гидроксида натрия. Наблюдения запишите.
2) Положите в пробирку немного мела, добавьте
разбавленную азотную кислоту.
3) Положите в пробирку немного оксида меди(II),
добавьте разбавленную азотную кислоту. Какого
цвета раствор? Зажмите пробирку в держателе и
погрейте. Как изменяется цвет раствора? О чем
говорит изменение цвета? – Прим. ред.
Н.В.КРАСНОВА,
учитель химии средней школы № 2
(с. Приволжье, Самарская обл.)
Они также являются сильными окислителями и бурно реагируют с широким спектром неметаллических веществ. Продукты этих взрывных реакций зависят от температуры, концентрации кислоты и используемого восстановителя.
Кислород: химия кислорода
Кислород является главной подгруппой VI группы (или 16 группы в последней форме ETS) и включен во второй период периодической таблицы химических элементов Д. Менделеева.
Электронная конфигурация кислорода в основном состоянии выглядит следующим образом.
+8O 1s 2 2s 2 2p 4 1s 2p
Атомы кислорода содержат два неспаренных электрона на внешнем энергетическом уровне и два неспаренных электрона в основном состоянии.
В промышленности кислород получают путем перегонки жидкого воздуха.
Экспериментальные методы получения кислорода:.
Разложение перманганата калия:.
Разложение позвоночных солей в присутствии катализатора MnO.2 :.
2KClO3 →2KCl+3O2
Разложение пероксида водорода в присутствии оксида марганца (IV):.
2HgO → 2Hg+O2
Соединения кислорода
Основные состояния окисления кислорода + 2, + 1, 0, -1 и -2.
Оксиды металлов и неметаллов Na2O, SO2 и т.д.
Кислородсодержащие соли
Органические вещества, содержащие кислород
При нормальных условиях чистый кислород является очень активным веществом и мощным окислителем. В воздухе окисляющая способность кислорода не так сильна.
1. кислород проявляет окислительные (включая большинство химических элементов) и восстановительные (включая только наиболее электроотрицательные фториды) свойства. Как окислитель, кислород реагирует как с металлами, так и с неметаллами. Большинство реакций горения простых веществ в кислороде протекают очень бурно и иногда сопровождаются взрывами.
1.1 Кислород реагирует с фтором с образованием фторированного кислорода.
Кислород фактически не реагирует с хлором или бромом, но только при определенных очень жестких условиях.
1.2 Кислород реагирует с серой и кремнием, образуя оксиды.
1.3 Фосфор сгорает с кислородом с образованием оксидов.
При недостатке кислорода может образоваться оксид фосфора (III).
Однако в большинстве случаев фосфор сгорает с образованием оксида фосфора (V).
1.4 Кислород реагирует с азотом в разряде или при очень высоких температурах (2000°C) с образованием оксида азота (II).
N2 + O2 →2NO
1.5 В реакциях со щелочноземельными металлами, литием и алюминием кислород также является окислителем. Образуются оксиды:.
2Ca + O2 → 2CaO
Однако при сжигании натрия в кислороде образуется в основном пероксид натрия.
2Na + O2 → нет.2O2
Калий, рубидий и цезий, с другой стороны, при сгорании образуют смесь продуктов, в основном пероксидов.
K + O2 → КО2
Переходные металлы обычно окисляют кислород до устойчивого состояния окисления.
Цинк окисляется до оксида цинка (II):.
2Zn + O2 →2ZnO
Железо образует либо оксид железа (II), либо оксид железа (III), либо железный фон, в зависимости от количества кислорода.
2Fe + O2 →2FeO
4Fe + 3 O2 →2Fe2O3
3Fe + 2 O2 →2Fe3O4
1.6 При нагревании в большом количестве кислорода графит сгорает с образованием монооксида углерода (IV).
При недостатке кислорода образуется монооксид углерода CO.
2C + O2 → 2CO
Алмазы горят при высоких температурах:.
Горение алмазов в жидком кислороде:.
1,1 литра воды весит приблизительно 998,5 грамма. 2. 1 литр мелко измельченной поваренной соли весит 1 кг 200 г. 3. при температуре +20°C масса 1 л концентрированной серной кислоты составляет 1,83 кг (1830 г). 4. при температуре +200°C средний вес литра подсолнечного масла составляет 0,92-0,93 кг (920-930 г).
Азотная кислота HNO3 свойства
Молекулярная масса: 63,012 г/моль Внешний вид: бесцветная или дымящаяся желтовато-красная жидкость Запах: неприятно горький или резкий, удушливый
Сопряженное основание: нитрат Показатель кислотности (pKa): -1,4
Температура плавления: 231 K или -42 °C. Температура кипения: 356 K или 83 °C (чистая кислота). Плотность: 1,51 г / см3 (чистая кислота) — 1,41 г / см3 (68% водный раствор)
Структура
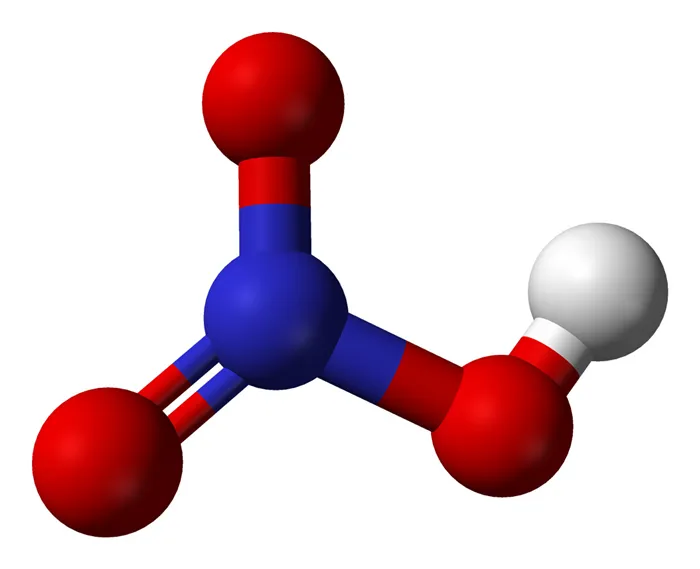
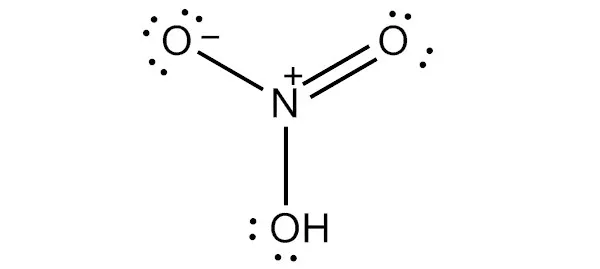
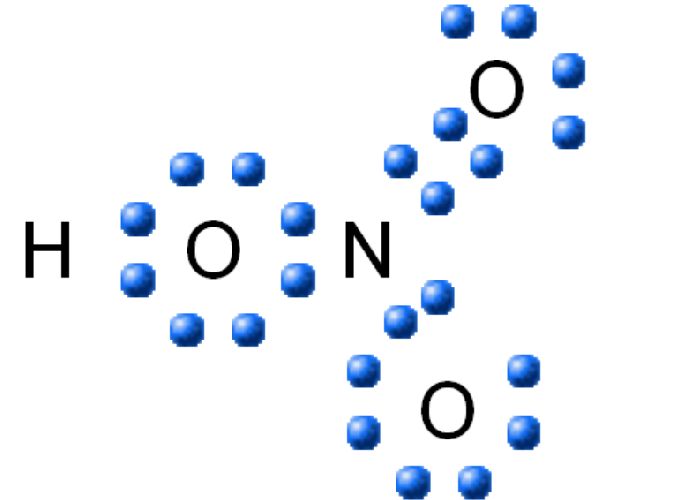
HNO3 имеет один атом азота (синий), один атом водорода (белый) и три атома кислорода (красный). Атом азота связан со всеми тремя атомами кислорода и несет заряд +1. Один атом кислорода несет заряд -1, один связан с водородом, а другой образует двойную связь с азотом.
Кислород вообще имеет тенденцию притягивать больше электронов, чем азот, поэтому он несет отрицательный заряд, в то время как атом азота несет положительный заряд.
Структура Льюиса
Чтобы составить структурную формулу Льюиса для азотной кислоты, необходимо рассчитать общее число валентных электронов в молекуле HNO3.
- Валентный электрон в одном атоме азота = 5
- Валентный электрон в одном атоме водорода = 1
- Валентный электрон в трех атомах кислорода = 18 (6*3)
Это дает общее число валентных электронов в молекуле HNO (5 + 1 + 18).3. Поскольку азот имеет больше валентных электронов, чем кислород, атом азота может быть помещен в центр структуры.
Следующий шаг — формирование связей и маркировка простых пар особей. Далее, каждый атом заряжается. Атом азота получает заряд +2, а два атома кислорода — заряд -1.
Наконец, нагрузка на атомы должна быть сведена к минимуму, чтобы стабилизировать структуру. Это может быть сделано путем преобразования простых пар в атомы кислорода внутри связи. Конечная структура состоит из двух одинарных связей между атомом азота и двумя атомами кислорода и двойной связи между атомом азота и остаточным атомом кислорода.
Существует два правильных способа построения структурной формулы HNO Льюиса3(1) Структурная формула Льюиса HNO. Поэтому существует два основных формата координации. Двунаправленные стрелки на изображении выше показывают, что существует несколько способов создания структуры азотной кислоты.
Как она производится?
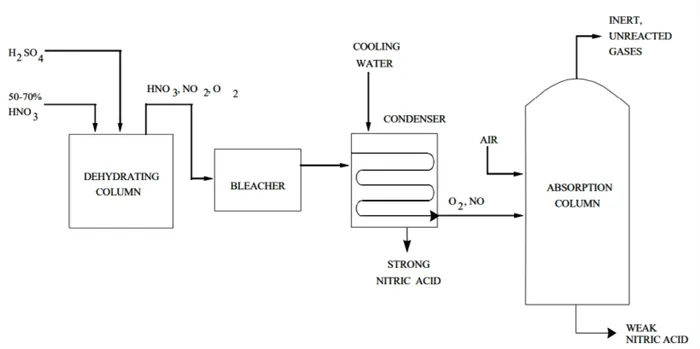
Для получения HNO используются два метода3 Используются два метода. Первый синтезирует HNO у пациентов с помощью окисления, концентрации и поглощения3 в концентрациях от 30 до 70 процентов. Во втором случае образуется сильная HNO3 (90-процентная концентрация) от пациентов с HNO.3 В нем сочетаются процессы обезвоживания, отбеливания, конденсации и абсорбции.
Производство слабой азотной кислоты
Большая часть азотной кислоты производится путем контактного окисления аммиака при высоких температурах. Это известно как процесс Оствальда. Он состоит из трех этапов.
1) Окисление аммиака.
Смесь аммиака и воздуха (1:9) окисляется при высоких температурах (750-800°C), проходя через каталитический конвертер. Катализатор обычно состоит из 90% платины и 10% родия. В результате этой (экзотермической) реакции образуются оксиды азота и вода в виде пара.
(2) Окисление оксида азота.
Оксид азота, образовавшийся в предыдущей реакции, окисляется: он некаталитически реагирует с остаточным кислородом, образуя диоксид азота. Это медленная и гомогенная реакция, которая сильно зависит от давления и температуры. При высоком давлении и низкой температуре в результате этой реакции образуется максимальное количество диоксида азота за очень короткое время.
3) Поглощение.
В последней реакции оксид азота поглощается водой. В результате получается желаемый продукт (азотная кислота в разбавленном виде) вместе с закисью азота. Концентрация HNO3 концентрация зависит от давления, температуры, количества ступеней абсорбции и концентрации оксида азота, поступающего в абсорбер.
Существует два правильных способа построения структурной формулы HNO Льюиса3(1) Структурная формула Льюиса HNO. Поэтому существует два основных формата координации. Двунаправленные стрелки на изображении выше показывают, что существует несколько способов создания структуры азотной кислоты.
Лекция № 11. Энергетический обмен
Энергетический метаболизм (катаболизм, анаболизм) — это совокупность реакций распада органических веществ с выделением энергии. Энергия, выделяемая при расщеплении органических веществ, не используется клеткой сразу, а запасается в виде АТФ и других высокоэнергетических соединений. АТФ является универсальным источником энергии для клетки. АТФ образуется в клетках всех организмов в процессе фосфорилирования — присоединения неорганического фосфата к АДФ.
У аэробных организмов (живущих в среде, лишенной кислорода) существует три стадии энергетического метаболизма: подготовка-окисление, окисление без кислорода, окисление кислорода; у анаэробных организмов (живущих в среде, насыщенной кислородом) стадии: подготовка без кислорода, окисление.
Подготовительный этап
Она заключается в ферментативном расщеплении сложных органических веществ на простые, например, белковых молекул на аминокислоты, жиров на глицериновые кислоты и карбоновые кислоты, углеводов на глюкозу и нуклеиновых кислот на нуклеотиды. Расщепление высокомолекулярных органических соединений осуществляется желудочно-кишечными или лизосомальными ферментами. Вся высвобождаемая энергия распространяется в виде тепла. Образовавшиеся небольшие органические молекулы могут быть использованы в качестве «структурного материала» или для дальнейшего расщепления.
Эта стадия заключается в дальнейшем расщеплении органического материала, образовавшегося на стадии подготовки, которое происходит в цитоплазме клетки и не требует присутствия кислорода. Основным источником энергии в клетке является глюкоза. Процесс неполного распада глюкозы без участия кислорода — это гликолиз.
Потеря электронов называется окислением, а увеличение — уменьшением; доноры электронов окисляются, а приемники уменьшаются.
Следует отметить, что биологическое окисление в клетках может происходить как с участием кислорода, так и без него.
или, если этого не происходит, путем переноса атомов водорода из одного вещества в другое. Например, вещество «А» окисляется в ущерб веществу «В».
Или посредством переноса электронов, например, в трехкольцевом железе окисляется один миллиард железа.
Гликолиз — это сложный многоступенчатый процесс, включающий 10 реакций. В ходе этого процесса глюкоза дегидратируется, а коферменты NAD+ (никотинамид динуклеотид аденин) действуют как приемники водорода. Глюкоза преобразуется в две молекулы пирувата (ПВС) по цепи2:.
Судьба ПВА зависит от наличия кислорода в клетке. В отсутствие кислорода в пастбищах и растениях происходит спиртовое брожение, при котором сначала образуется альдегид уксусная кислота, а затем этиловый спирт.
У животных и некоторых бактерий молочнокислое брожение происходит в отсутствие кислорода в результате образования молочной кислоты.
В результате гликолиза молекул глюкозы высвобождается 200 кДж, из которых 120 кДж рассеивается в виде тепла, а 80% сохраняется в связях АТФ.
Кислородное окисление, или дыхание
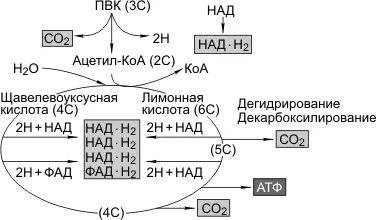
Включено полное расщепление пирувата, происходящее в митохондриях, которое должно происходить в присутствии кислорода.
Пируват переносится в митохондрии (Структура и функция митохондрий — лекция 7). Здесь ПВС вступает в цикл реакций, называемый циклом Кребса, в котором дегидратация (удаление водорода) и восстановление (удаление углекислого газа) образуют группу двухуглеродных ацетилов. Происходит дальнейшее окисление, включая дегидрирование и декарбоксилирование. В результате три выброса CO2Образуются пять пар атомов водорода2fad-h2), и молекулы АТФ.
Общая реакция гликолиза и распада АТФ в митохондрии на водород и углекислый газ выглядит следующим образом
Две молекулы АТФ образуются в результате гликолиза, две — в результате цикла KREBS; две пары атомов водорода (2HADCHN2) образуются в результате гликолиза, 10-парный цикл KREBS; два атома водорода (2HADCHN2) образуются в результате цикла KREBS, 10-парный цикл KREBS.
Последним шагом является окисление пары атомов водорода кислородом в воде, но при этом происходит фосфорилирование АДФ из АТФ. Водород переносится на три больших ферментных комплекса (флавопротеины, коэнзим Q и цитохром) в дыхательной цепи, расположенной во внутренней мембране митохондрий. Водород отнимает электроны и в конечном итоге соединяется с кислородом в митохондриальной матке.
Купить Контрольная работа и тест по биологии


Протоны направляются в область бранеуса митохондрий, которая является «резервуаром для протонов». Внутренняя мембрана не может быть пронизана ионами водорода — с одной стороны, она заряжена отрицательно (из-за O2 — ), с другой стороны, он заряжен положительно (для H+). Когда динамическая разница во внутренней мембране достигает 200 мВ, протоны проходят через ферментный канал АТФ-синтазы, вырабатывается АТФ, а цитохроматическая оксидаза исключает восстановление кислорода. Таким образом, окисление 12 атомов водорода приводит к образованию 34 молекул АТФ.
1 — наружная мембрана — 2 — пространство средней мембраны, протонный резервуар — 3 — цитохром — 4 — ат.
Окисление NAD-H при перфорации внутренней митохондриальной мембраны.2 Окисление NAD-H продолжается, но синтез АТФ не функционирует, и АТФ не образуется в дыхательной цепи. Энергия распространяется в виде тепла (бурые жировые клетки млекопитающих).
Общая реакция распада глюкозы на углекислый газ и воду выглядит следующим образом
Переход к лекции 10 «Концепции метаболизма. Биосинтез белка».
Существует два правильных способа построения структурной формулы HNO Льюиса3(1) Структурная формула Льюиса HNO. Поэтому существует два основных формата координации. Двунаправленные стрелки на изображении выше показывают, что существует несколько способов создания структуры азотной кислоты.
Как применяют
Сбор и распознавание необходимы для выделения чистого кислорода. Чистый кислород используется в промышленности для окисления веществ и поддержания зон под водой и заполненных дымом (кислород необходим пожарным). В медицине кислородные баллоны помогают пациентам с затрудненным дыханием. Кислород также используется для лечения респираторных заболеваний.
Кислород используется при сжигании топлива — углерода, нефти и газа. Кислород широко используется в металлургии и машиностроении. Плавление, резка и сварка металлов.
Яркая окраска фейерверков обусловлена передачей электронов металлическим людям, соединения которых вводятся в пиротехническую смесь. Желтая окраска фейерверков вызвана людьми
Вопрос 6 из 25
Четыре одинаковые пробирки были полностью заполнены водой (1), мелко измельченной поваренной солью (2), серной кислотой (3) и подсолнечным маслом (4). Затем пробирки взвешивались. Какая из них имеет наименьшую массу?
Наш ответ — номер 4.
1,1 литра воды весит приблизительно 998,5 грамма.
2. 1 литр мелко измельченной поваренной соли весит 1 кг 200 г.
3. при температуре +20°C масса 1 л концентрированной серной кислоты составляет 1,83 кг (1830 г).
4. средний вес литра подсолнечного масла при температуре +200°C соответствует 0,92-0,93 кг (920-930 г).
Вопрос 7 из 25
Известно, что озон O3 в верхних слоях атмосферы поглощает жесткое ультрафиолетовое (UVB) излучение солнца и тем самым защищает поверхность Земли. Однако сам озон также образуется в атмосфере под воздействием ультрафиолетового излучения. Откуда она берется?
Ответ: кислород.
Озон образуется из ультрафиолетового (УФ) света и углекислого газа с его выбросом в атмосферу Земли.
Вопрос 8 из 25
Когда водолаз всплывает с глубины, внешнее давление быстро падает, и газ, растворенный в крови под давлением, выделяется в виде пузырьков. Это приводит к образованию пузырьков в крови. Для предотвращения этого водолаза немедленно помещают в декомпрессионную камеру. Какой газ ответственен за это явление?
Наш ответ: азот.
В норме это индифферентный газ, не участвующий в метаболических процессах. Однако под давлением азот становится наркотиком и, что еще опаснее, растворяется в крови и тканях и буквально «кипит» (выделяется в свободную фазу в виде пузырьков) при падении давления.
Азотная кислота

3.9
Средняя оценка: 3.9
Всего получено оценок: 940.
3.9
Средняя оценка: 3.9
Всего получено оценок: 940.
Азотная кислота относится к основным соединениям азота. Химическая формула – HNO3. Так какими же физическими и химическими свойствами обладает это вещество?
Физические свойства
Чистая азотная кислота не имеет цвета, обладает резким запахом, а на воздухе имеет особенность “дымиться”. Молярная масса составляет 63 г/моль. При температуре -42 градуса переходит в твердое агрегатное состояние и превращается в белоснежную массу. Безводная азотная кислота закипает при 86 градусах. В процессе смешивания с водой образует растворы отличные друг от друга по концентрации.
Данное вещество является одноосновной, то есть всегда имеет одну карбоксильную группу. Среди кислот, которые относятся к мощным окислителями, азотная кислота является одной из сильнейших. Она вступает в реакцию со многими металлами и неметаллами, органическими соединениями за счет восстановления азота
Нитраты – соли азотной кислоты. Чаще всего их используют в качестве удобрений в сельском хозяйстве
Химические свойства
Электронную и структурную формулу азотной кислоты изображают следующим образом:
Концентрированная азотная кислота подвержена воздействию света и под его действием способна разлагаться на оксиды азота. Оксиды, в свою очередь, взаимодействуя с кислотой, растворяются в ней и придают жидкости желтоватый оттенок:
4HNO3=4NO2+O2+2H2O
Хранить вещество следует в прохладном и темном месте. При повышении ее температуры и концентрации процесс распада происходит значительно быстрее. Азот в молекуле азотной кислоты всегда имеет валентность IV, степень окисления +5, координационное число 3.
Так как азотная кислота является очень сильной кислотой, в растворах она полностью разлагается на ионы. Она реагирует с основными оксидами, с основаниями, с солями более слабых и более летучих кислот.
Эта одноосновная кислота – сильнейший окислитель. Азотная кислота действует на многие металлы. В зависимости от концентрации, активности металла и условий проведения реакции может восстанавливаться с одновременным образованием соли азотной кислоты (нитрата) до соединений.
Когда азотная кислота взаимодействует с малоактивными металлами образуется NO2:
Cu+4HNO3 (конц.)=Сu(NO3)2 +2NO2+2H2O
Разбавленная азотная кислота в такой ситуации восстанавливается до NO:
3Cu+8HNO3(разб.)=3Сu(NO3)2 +2NO+4H2O
Если в реакцию с разбавленной азотной кислотой вступают более активные металлы, то выделяется NO2:
4Mg+10HNO3 (разб.)=4Mg(NO3)2+N2O+5H2O
Очень разбавленная азотная кислота при взаимодействии с активными металлами восстанавливается до солей аммония:
4Zn+10HNO3 (очень разб.)=4Zn(NO3)2+NH4NO3+3H2O
В концентрированной азотной кислоте устойчивы Au, Pt, Rh, Ir, Ta, Ti. Металлы Al, Fe, Cr она «пассивирует» в результате образования на поверхности металлов оксидных пленок.
Смесь, образованная из одного объема концентрированной азотной и трех объемов концентрированной хлороводородной (соляной) кислоты называется «царской водкой».
Неметаллы окисляются азотной кислотой до соответствующих кислот, а азотная кислота в зависимости от концентрации восстанавливается до NO или NO2:
С+4HNO3 (конц.)=CO2+4NO2+2H2O
S+6HNO3 (конц.)=H2SO4+6NO2+2H2O
Азотная кислота способна окислять некоторые катионы и анионы, а также неорганические ковалентные соединения, например, сероводород.
3H2S+8HNO3 (разб.)= 3H2SO4 +8NO+4H2O
Азотная кислота взаимодействует со многими органическими веществами, при этом один или несколько атомов водорода в молекуле органического вещества заменяются нитрогруппами – NO2. Этот процесс называется нитрованием.
Что мы узнали?
Азотная кислота – жидкость, которая не имеет цвета, но обладает резким запахом. Особенностью этой кислоты является то, что она может смешиваться с водой в любых соотношениях. Азотная кислота также обладает рядом свойств. Она может вступать в реакцию, например, с металлами, неметаллами, оксидами, основаниями и др.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Олег Гаврюшкин
10/10
-
Ирина Лебедь
10/10
-
Игорь Самусев
8/10
Оценка доклада
3.9
Средняя оценка: 3.9
Всего получено оценок: 940.
А какая ваша оценка?
Атомы элементов второго периода не имеют свободных d-подуровней. Поэтому фтор проявляет только одну валентность, равную единице, кислород — двухвалентен, а азот — трехвалентен. Как же в таком случае объяснить строение молекул азотной кислоты HNO3? Приводимая обычно в учебниках структурная формула 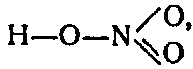
Один электрон атома азота переходит в электронную оболочку атома кислорода. Возникший при этом ион N+
образует четыре ковалентные связи. Таким образом, в молекуле азотной кислоты азот действительно пятивалентен, однако одна его связь ионная, а другие четыре — ковалентные.
У азотной кислоты hno3 структурная формула совершенно равнозначна, но, поскольку из опыта известно, что два не соединенных с водородом атома кислорода в молекуле HNO3 неразличимы, каждая из этих формул в отдельности неверна. Лишь вместе они правильно отражают строение азотной кислоты. Чтобы показать это, пользуются знаком «резонанса»⇔,который обозначает,что истинное строение выражается некоторой промежуточной формулой:
Не нужно путать знак резонанса со знаком обратимости (⇄). Электроны не прыгают с одного атома кислорода на другой, чтобы «давать» то одну, то другую форму. Реальная молекула соответствует наложению крайних структур.
Поскольку электрон имеет корпускулярно-волновую природу, его можно считать как бы «размазанным» между, двумя атомами кислорода. Тогда вместо двух резонансных структур можно написать следующую формулу, отражающую строение молекулы азотной кислоты.
Статья на тему Строение молекулы HNO3
Понравилась статья поделись ей
Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 + H2SO4(конц) → KHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциирует в водном растворе.
HNO3 → H+ + NO3–
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, азотная кислота взаимодействует с оксидом меди (II):
CuO + 2HNO3 → Cu(NO3)2 + H2O
Еще пример: азотная кислота реагирует с гидроксидом натрия:
HNO3 + NaOH → NaNO3 + H2O
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например, азотная кислота взаимодействует с карбонатом натрия:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
4. Азотная кислота частично разлагается при кипении или под действием света:
4HNO3 → 4NO2 + O2 + 2H2O
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + N2O + 5H2O
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
8HNO3 (разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
12HNO3(разб) + 10Na → 10NaNO3 + N2 + 6H2O
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
Таблица. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3 + S → H2SO4 + 6NO2 + 2H2O
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
5HNO3 + P → H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
4HNO3 + C → CO2 + 4NO2 + 2H2O
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O
7. Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например, азотная кислота окисляет оксид серы (IV):
2HNO3 + SO2 → H2SO4 + 2NO2
Еще пример: азотная кислота окисляет иодоводород:
6HNO3 + HI → HIO3 + 6NO2 + 3H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например, сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
2HNO3 + H2S → S + 2NO2 + 2H2O
При нагревании до серной кислоты:
2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.