1. Положение фосфора в периодической системе химических элементов
2. Строение атома фосфора
3. Физические свойства и нахождение в природе
4. Строение молекулы
5. Соединения фосфора
6. Способы получения
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с кислородом
7.1.2. Взаимодействие с галогенами
7.1.3. Взаимодействие с серой
7.1.4. Взаимодействие с металлами
7.1.5. Взаимодействие с активными металлами
7.1.6. Взаимодействие с водородом
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с окислителями
7.2.2. Взаимодействие с щелочами
Фосфин
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Основные свойства
3.2. Взаимодействие с кислородом
3.3. Восстановительные свойства
Фосфиды
Способы получения фосфидов
Химические свойства фосфидов
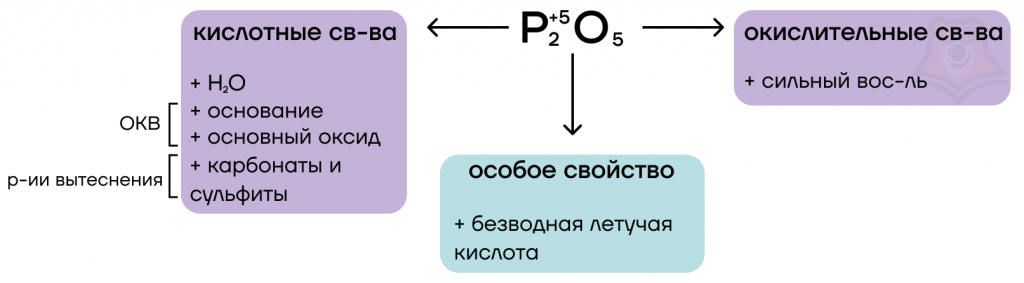
Оксиды фосфора
1. Оксид фосфора (III)
2. Оксид фосфора (V)
Фосфорная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация фосфорной кислоты
3.2. Кислотные свойства фосфорной кислоты
3.3. Взаимодействие с солями более слабых кислот
3.4. Разложение при нагревании
3.5. Взаимодействие с металлами
3.6. Качественная реакция на фосфат-ионы
Фосфористая кислота
Соли фосфорной кислоты
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии:
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
Белый фосфор:
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Красный фосфор – это модификация с атомной кристаллической решеткой. Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое. Это гораздо более устойчивая модификация, чем белый фосфор. В темноте не светится. Образуется из белого фосфора при t=250-300оС без доступа воздуха.
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
Черный фосфор:
Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор, который очень хорошо проводит электрический ток.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +5 | оксид фосфора (V) P2O5
ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 пирофосфорная кислота H4P2O7 фосфаты MePO4 Гидрофосфаты MeНРО4 Дигидрофосфаты MeН2РО4 Галогенангидриды: PОCl3, PCl5 |
| +3 | Оксид фосфора (III) P2O3
Фосфористая кислота H3PO3 Фосфиты MeHPO3 Галогенангидриды: PCl3 |
| +1 | Фосфорноватистая кислота H3PO2
Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3
Фосфиды металлов MeP |
Способы получения фосфора
1. Белый фосфор получают из природных фосфатов, прокаливая их с коксом и песком в электрической печи:
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 5CO + 2P
2. Вместо фосфатов можно использовать другие неорганические соединения фосфора, например, метафосфорную кислоту.
4HPO3 + 10C → P4 + 2H2O + 10 CO
3. Красный и черный фосфор получают из белого фосфора.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами.
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот:
4P + 3O2 → 2P2O3
4P + 5O2 → 2P2O5
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
2P + 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
2P + 3S → P2S3
2P + 5S → P2S5
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P + 3Ca → Ca3P2
2P + 3Mg → Mg3P2
Еще пример: натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
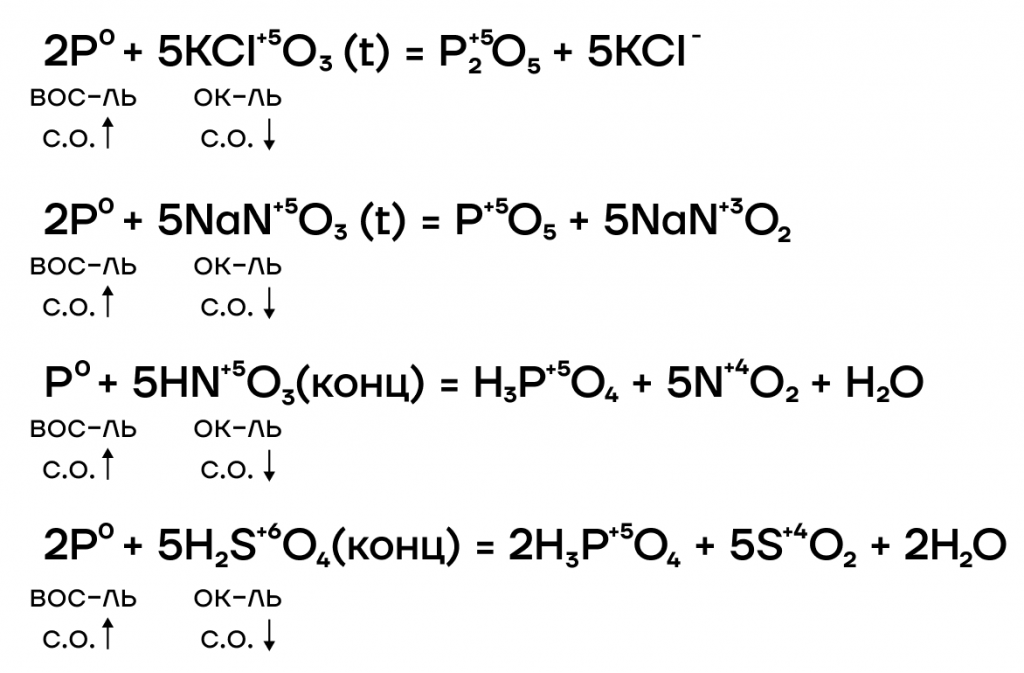
Например, азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO↑
Серная кислота также окисляет фосфор:
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
Соединения хлора, например, бертолетова соль, также окисляют фосфор:
6P + 5KClO3 → 3P2O5 + 5KCl
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Некоторые металлы-сильные окислители также окисляют фосфор. Например, оксид серебра (I):
2P + 5Ag2O → P2O5 + 10Ag
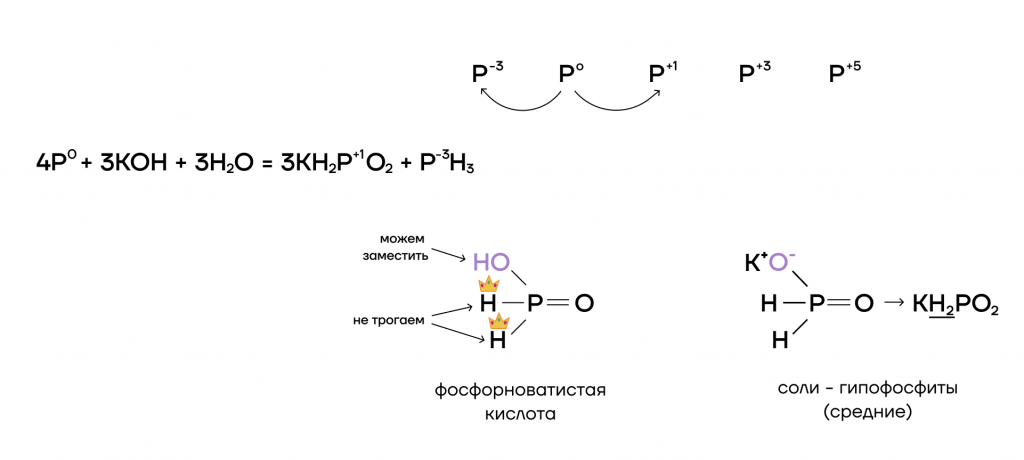
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например, фосфор реагирует с гидроксидом калия:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑ или
P4 + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Или с гидроксидом кальция:
8P + 3Ca(OH)2 + 6H2O → 3Ca(H2PO2)2 + 2PH3↑
Фосфин
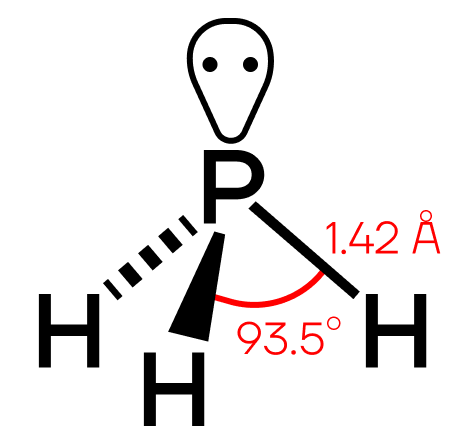
Строение молекулы и физические свойства
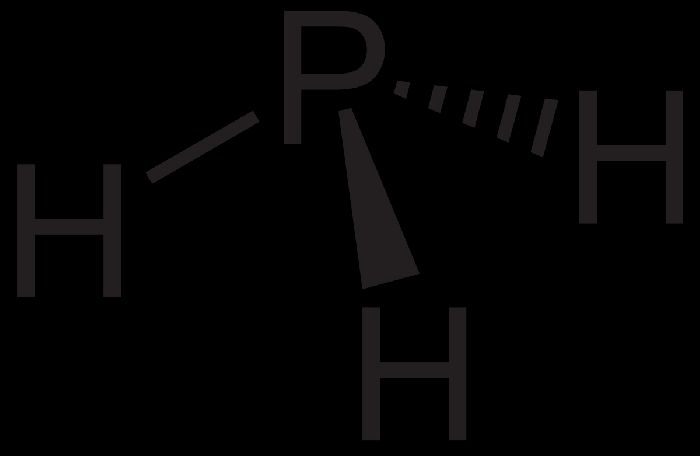
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5о.
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например, фосфин образуется при водном гидролизе фосфида кальция:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3
Или при кислотном гидролизе, например, фосфида магния в соляной кислоте:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например, фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Химические свойства фосфина
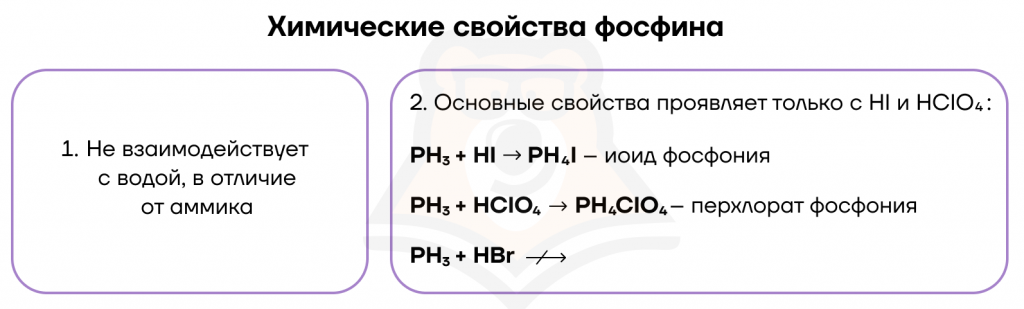
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами.
Например, фосфин реагирует с йодоводородной кислотой:
PH3 + HI → PH4I
Соли фосфония неустойчивые, легко гидролизуются.
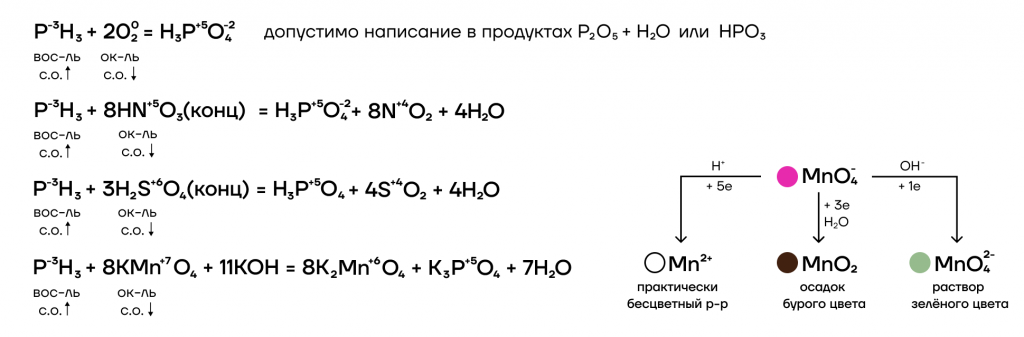
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
2PH3 + 4O2 → P2O5 + 3H2O
PH3 + 2O2 → H3PO4
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например, азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
PH3 + 8HNO3 → H3PO4 + 8NO2 + 4H2O
Серная кислота также окисляет фосфин:
PH3 + 3H2SO4 → H3PO4 + 3SO2 + 3H2O
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например, хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Фосфиды
Фосфиды – это бинарные соединения фосфора и металлов или некоторых неметаллов.
Способы получения фосфидов
Фосфиды получают при взаимодействии фосфора с металлами. При этом фосфор проявляет свойства окислителя.
Например, фосфор взаимодействует с магнием и кальцием:
2P + 3Mg → Mg3P2
2P + 3Ca → Ca3P2
Фосфор взаимодействует с натрием:
P + 3Na → Na3P
Химические свойства фосфидов
1. Фосфиды легко разлагаются водой или кислотами с образованием фосфина.
Например, фосфид кальция разлагается водой:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3↑
Фосфид магния разлагается соляной кислотой:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
2. Фосфиды металлов проявляют сильные восстановительные свойства за счет фосфора в степени окисления -3.
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Оксид фосфора (III) – это кислотный оксид. Белые кристаллы при обычных условиях. Пары состоят из молекул P4O6.
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода:
4P + 3O2 → 2P2O3
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
Например, оксид фосфора (III) диспропорционирует в горячей воде:
2Р2О3 + 6Н2О (гор.) → РН3 + 3Н3РО4
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
Например, N2O окисляется кислородом:
Р2О3 + О2 → Р2О5
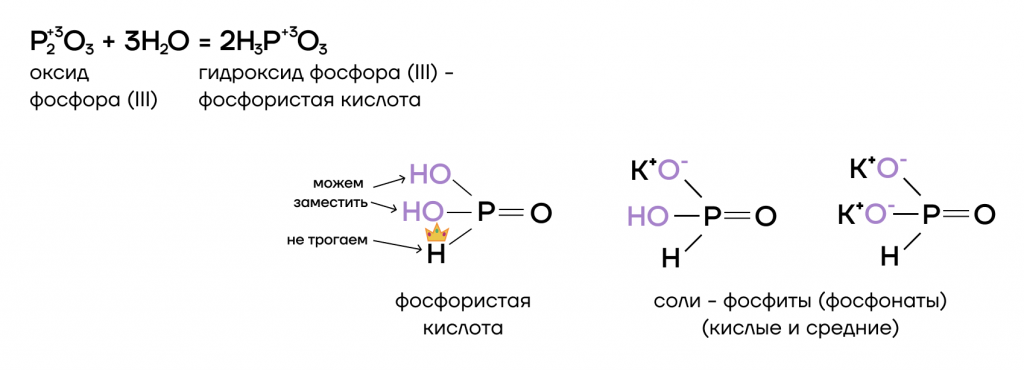
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
Р2О3 + 3Н2О → 2Н3РО3
а со щелочами – с образованием солей (фосфитов):
Р2О3 + 4KOH → 2K2HРО3 + H2O
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
4P + 5O2 → 2P2O5
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например, оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2HNO3 → 2HPO3 + N2O5
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
2. Фосфорный ангидрид является типичным кислотным оксидом, взаимодействует с водой с образованием фосфорных кислот:
P2O5 + 3H2O → 2H3PO4
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
P2O5 + 2H2O → 2H4P2O7
P2O5 + H2O → HPO3
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями.
Например, оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
Еще пример: оксид фосфора взаимодействует с оксидом бария (при сплавлении):
P2O5 + 3BaO → Ba3(PO4)2
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 + 3H2O → 2H3PO4
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая).
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
H3PO4 ⇄ H+ + H2PO4–
H2PO4– ⇄ H+ + HPO42–
HPO42– ⇄ H+ + PO43–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, фосфорная кислота взаимодействует с оксидом магния:
2H3PO4 + 3MgO → Mg3(PO4)2 + 3H2O
Еще пример: при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
H3PO4 + КОН → KH2РО4 + H2O
H3PO4 + 2КОН → К2НРО4 + 2H2O
H3PO4 + 3КОН → К3РО4 + 3H2O
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например, фосфорная кислота взаимодействует с гидрокарбонатом натрия:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, фосфорная кислота реагирует с магнием:
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
2H3PO4 + 3NH3 → NH4H2PO4 + (NH4)2HPO4
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфористая кислота
Фосфористая кислота H3PO3 — это двухосновная кислородсодержащая кислота. При нормальных условиях бесцветное кристаллическое вещество, хорошо растворимое в воде.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Получение фосфористой кислоты.
Фосфористую кислоту можно получить гидролизом галогенидов фосфора (III).
Например, гидролизом хлорида фосфора (III):
PCl3 + 3H2O → H3PO3 + 3HCl
Фосфористую кислоту можно получить также взаимодействием оксида фосфора (III) с водой:
Р2О3 + 3Н2О → 2Н3РО3
Химические свойства.
1. Фосфористая кислота H3PO3 в водном растворе — двухосновная кислота средней силы. Взаимодействует с основаниями с образованием солей-фосфитов.
Например, при взаимодействии с гидроксидом натрия фосфористая кислота образует фосфит натрия:
H3PO3 + 2NaOH → Na2HPO3 + 2H2O
2. При нагревании фосфористая кислота разлагается на фосфин (Р-3) и фосфорную кислоту (Р+5):
4H3PO3 → 3H3PO4 + PH3
3. За счет фосфора в степени окисления +3 фосфористая кислота проявляет восстановительные свойства.
Например, H3PO3 окисляется перманганатом калия в кислой среде:
5H3PO3 + 2KMnO4 + 3H2SO4 → 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
Еще пример: фосфористая кислота окисляется соединениями ртути (II):
H3PO3 + HgCl2 + H2O → H3PO4 + Hg + 2HCl
Соли фосфорной кислоты — фосфаты
Фосфорная кислота образует разные типы солей: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
1. Качественная реакция на фосфаты — взаимодействие с нитратом серебра. При этом образуется желтый осадок фосфата серебра.
K3PO4 + 3AgNO3 → Ag3PO4↓ + 3KNO3
2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты.
Например, фосфат кальция реагирует с фосфорной кислотой с образованием дигидрофосфата кальция:
Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
Фосфат кальция растворяется под действием серной кислоты:
Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4
3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями.
Например, фосфат кальция при сплавлении реагирует с углеродом с образованием фосфида кальция и угарного газа:
Ca3(PO4)2 + 8C → Ca3P2 + 8CO
Фосфат кальция также восстанавливается алюминием при сплавлении:
3Ca3(PO4)2 + 16Al → 3Ca3P2 + 8Al2O3
4. Гидрофосфаты могут взаимодействовать и с более сильными кислотами, и с щелочами. Под действием фосфорной кислоты гидрофосфаты переходят в дигидрофосфаты.
Например, гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
K2HPO4 + H3PO4 → 2KH2PO4
Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия:
K2HPO4 + KOH → K3PO4 + H2O
5. Дигидрофосфаты могут взаимодействовать с более сильными кислотами и щелочами, но не реагируют с фосфорной кислотой.
Например, дигидрофосфат натрия взаимодействует с избытком гидроксида натрия с образованием фосфата:
NaH2PO4 + 2NaOH → Na3PO4 + 2H2O
Фосфор (греч. phos — свет + phoros — несущий) — химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество,
легко воспламеняющееся и светящееся.

Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.

Природные соединения
В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*Ca(OH,F)2 — фосфорит
- Ca10(PO4)6(F,Cl,OH)2 — апатит

Получение
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Ca3(PO4)2 + SiO2 + C → (t) CaSiO3 + P + CO
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый
фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до
P2.
- Реакции с неметаллами
- Реакции с металлами
- Реакция с водой
- Реакция с щелочами
- Восстановительные свойства
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
4P + 3O2 → 2P2O3 (недостаток кислорода)
4P+ 5O2 → 2P2O5 (избыток кислорода)
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
P + S → P2S3
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ — фосфин — боевое
отравляющее вещество.
Ca3P2 + H2O → Ca(OH)2 + PH3↑

2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество
является и окислителем, и восстановителем).
P + H2O → (t) PH3 + H3PO4
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
P + LiOH + H2O → LiH2PO2 + PH3↑ (LiH2PO2 — гипофосфит лития)
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.
KClO3 + P → KCl + P2O5

Оксид фосфора V — P2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Получение
P + O2 → P2O5
Химические свойства
- Кислотные свойства
- Дегидратационные свойства
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
P2O5 + 3H2O = 2H3PO4
P2O5 + H2O = HPO3 (при недостатке воды)
Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль — определяет соотношение основного
оксида/основания и кислотного оксида.
P2O5 + Na2O → Na3PO4
6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи — соотношение 6:1)
4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида — соотношение 4:1)
2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида — соотношение 2:1)

Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
HClO4 + P2O5 → HPO3 + Cl2O7 (HPO3 — метафосфорная кислота)
HNO3 + P2O5 → HPO3 + N2O5
Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота — H3PO4 (трехосновная кислота, соли — фосфаты PO43-)
- Метафосфорная кислота — HPO3 (одноосновная кислота, соли — метафосфаты PO3—)
- Фосфористая — H3PO3 (двухосновная кислота, соли — фосфиты HPO32-)
- Фосфорноватистая — H3PO2 (одноосновная кислота, соли гипофосфиты — H2PO2— )
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
CuSO4 + H3PO2 + H2O → Cu + H2SO4 + H3PO4
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Получение
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора,
взаимодействия оксида фосфора V с водой.
Ca3(PO4)2 + H2SO4 → CaSO4 + H3PO4
P2O5 + H2O → H3PO4
PCl5 + H2O → H3PO4 + HCl
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
P + HNO3 + H2O → H3PO4 + NO

Химические свойства
- Кислотные свойства
- Реакции с солями
- Реакции с металлами
- Дегидратация
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные
соли (фосфаты, гидрофосфаты и дигидрофосфаты).
3K2O + H3PO4 = 2K3PO4 + 3H2O
3KOH + H3PO4 = K3PO4 + 3H2O
2KOH + H3PO4 = K2HPO4 + H2O
KOH + H3PO4 = KH2PO4 + H2O
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок
желтого цвета — фосфат серебра — образуется в результате реакции с нитратом серебра.
AgNO3 + H3PO4 → Ag3PO4 + HNO3
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
K2CO3 + H3PO4 → K3PO4 + H2O + CO2
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
Mg + H3PO4 → Mg3(PO4)2 + H2↑
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
H3PO4 → (t) HPO3 + H2O
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука — Ca3(PO4)2
- Простой суперфосфат — смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат — Ca(H2PO4)2*H2O
- Преципитат — CaHPO4*2H2O
- Костная мука — продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос — в основном состоит из моноаммонийфосфата — NH4H2PO4

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства фосфора

4.8
Средняя оценка: 4.8
Всего получено оценок: 370.
4.8
Средняя оценка: 4.8
Всего получено оценок: 370.
Фосфор – жизненно важный элемент из пятой группы периодической таблицы Менделеева. Химические свойства фосфора зависят от его модификации. Наиболее активным веществом является белый фосфор, окисляющийся на воздухе. Фосфор имеет две валентности (III и V) и три степени окисления – +5, +3, -3.
Фосфор и соединения
Фосфор имеет три аллотропические модификации, отличающиеся химическими и физическими свойствами:
- белый;
- красный;
- чёрный.
Под фосфором в химических реакциях чаще всего понимают белый фосфор (P4). Красный фосфор вступает в реакции при определённых условиях. Например, реагирует с водой при нагревании и под давлением. Чёрный фосфор практически инертен.
Фосфор реагирует с простыми и сложными веществами, образуя:
- фосфин;
- фосфорную кислоту;
- фосфиды;
- оксиды.
Фосфин (РН3) – плохо растворимый в воде ядовитый газ, аналог аммиака. В отсутствии кислорода при нагревании разлагается на простые вещества – фосфор и водород.
Фосфорная или ортофосфорная кислота (H3PO4) образуется при взаимодействии фосфора или оксида фосфора (V) с водой.
Фосфиды – соли, образующиеся при взаимодействии с металлами или неметаллами. Они неустойчивы и легко разлагаются под действием кислот или воды.
Фосфор может образовывать два оксида – P2O3 и P2O5.
H3PO4 – кислота средней силы, проявляющая амфотерные свойства при взаимодействии с сильной кислотой. Фосфорная кислота образует фосфаты.
Химические свойства
Основные химические свойства фосфора и его соединений описаны в таблице.
|
Вещество |
Реакция |
Особенности |
Уравнение |
|
Фосфор |
С O2 |
При избытке O2 образует оксид фосфора (V) |
– 4P + 5O2 → 2P2O5; – 4P + 3O2 → 2P2O3 |
|
С металлом |
Является окислителем |
3Mg + 2P → Mg3P2 |
|
|
С галогенами и неметаллами |
Не реагирует с водородом |
2P + 3S → P2S3 |
|
|
С Н2О |
8Р + 12Н2О → 5РН3 + 3Н3РО2 |
||
|
С кислотами |
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O |
||
|
Со щелочами |
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 |
||
|
РН3 |
С O2 |
Воспламеняется на воздухе |
РН3 + 2O2 → H3PO4 |
|
С галогенами и неметаллами |
РН3 + 2I2 + 2H2O → H(PH2O2) + 4HI |
||
|
С кислотами |
Проявляет свойства восстановителя |
РН3 + 3H2SO4 → H2(PHO2) + 3SO2 + 3H2O |
|
|
H3PO4 |
С металлами |
С активными металлами |
2H3PO4 + 3Ca → Ca3(PO4)2 + 3H2↑ |
|
С Н2О |
Подвергается диссоциации |
H3PO4 + H2O ↔ H3O+ + H2PO4– |
|
|
Со щелочами |
Образует кислые или щелочные фосфаты |
H3PO4 + 3NaOH → Na3PO4 + 3H2O |
|
|
С оксидами |
2H3PO4 + 3K2O → 2K3PO4 + 3H2O |
||
|
С солями |
2H3PO4 + 3CaCO3 → Ca3(PO4)2 + 3H2O + 3CO2↑ |
||
|
С аммиаком |
H3PO4 + 3NH3 → (NH4)3PO4 |
||
|
P2O3 |
С галогенами и неметаллами |
– 2P2O3 + 6Cl2 → 4PCl3O + O2; – 2P2O3 + 9S → P4S6 + 3SO2 |
|
|
С Н2О |
Медленно реагирует с холодной водой и быстро – с горячей |
P2O3 + 3H2O → 2H3PO3 |
|
|
Со щелочами |
P2O3 + 4NaOH → 2Na2HPO3 + H2O |
||
|
P2O5 |
С Н2О |
Реагирует с взрывом |
2P2O5 + 6H2O → 4H3PO4 |
|
С кислотами |
Реакция замещения |
4HNO3 + 2P2O5 → 4HPO3 + 2N2O5 |
|
|
Фосфиды |
С Н2О |
Образуют гидроксиды металлов и фосфин |
Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3 |
|
С кислотами |
Реакция замещения |
Ca3P2 + 6HCl → 3CaCl2 + 2PH3 |
При нагревании оксид фосфора распадается. Причём P2O3 образует красный фосфор, а P2O5 – оксид фосфора (III) и кислород.
Использование
Широкое применение имеют соединения фосфора:
- из фосфатов получают удобрения и моющие средства;
- фосфорная кислота используется для окрашивания ткани;
- оксид фосфора (V) осушает жидкости и газы.
Красный фосфор используется в производстве спичек и взрывчатых веществ.
Что мы узнали?
Фосфор – активный неметалл, реагирующий с простыми и сложными веществами. В результате реакций образует оксиды (III) и (V), фосфин, фосфорную кислоту и фосфиды. Соединения фосфора вступают в реакцию с металлами, неметаллами, кислотами, щелочами, водой. Фосфор и его соединения используются в промышленности и сельском хозяйстве.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Алина Батарова
5/5
Оценка доклада
4.8
Средняя оценка: 4.8
Всего получено оценок: 370.
А какая ваша оценка?
На этой странице вы узнаете
- О трех фосфорных братах;
- P2O5-разбойник: разберем, почему;
Фосфор был открыт в результате поисков философского камня. Хотели получить золото и бессмертие, а вместо этого обнаружили элемент, который светится зеленым цветом в темноте. Чем ещё отличается фосфор — расскажем в статье.
Общая характеристика
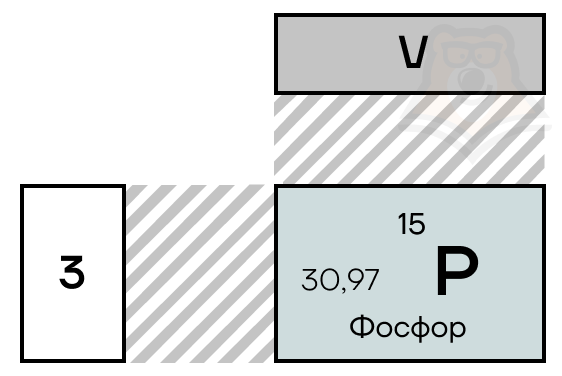
Фосфор находится в VA-группе третьего периода таблицы Менделеева, прямо под азотом. Электронная конфигурация фосфора в основном состоянии 1s22s22p63s23p3.
Конфигурация его внешнего слоя такая же, как и у азота. Но фосфор имеет на этом слое полностью свободный d-подуровень, куда в случае возбуждения атома может переехать его электрон.
Поэтому в возбужденном электронном состоянии атом фосфора имеет конфигурацию внешнего электронного уровня 3s13p33d1.
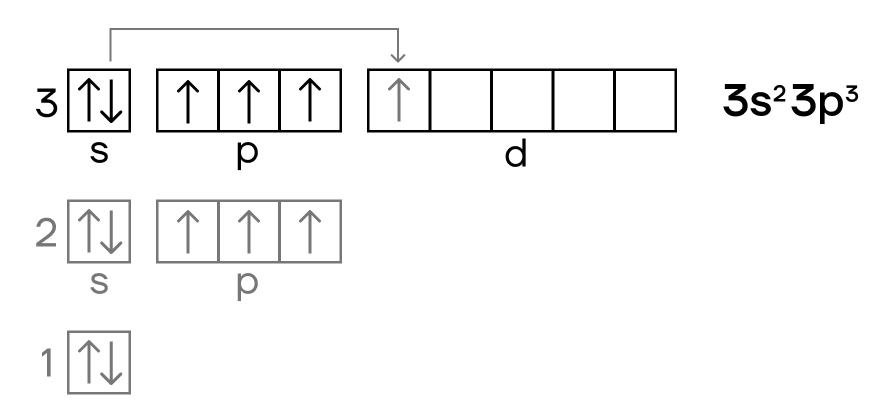
Таким образом, благодаря наличию в возбужденном состоянии пяти неспаренных электронов, фосфор может максимально образовывать в соединениях пять химических связей.
В отличие от азота, у фосфора максимальная валентность (V) и высшая степень окисления (+5) численно совпадают.
Какие степени окисления фосфора возможны?
- Высшая степень окисления равна номеру группы: +5.
- Низшая степень окисления определяется по формуле «номер группы — 8»: -3.
- Промежуточные степени окисления, как и сам номер группы, нечётные: +1, +3.
Физические свойства
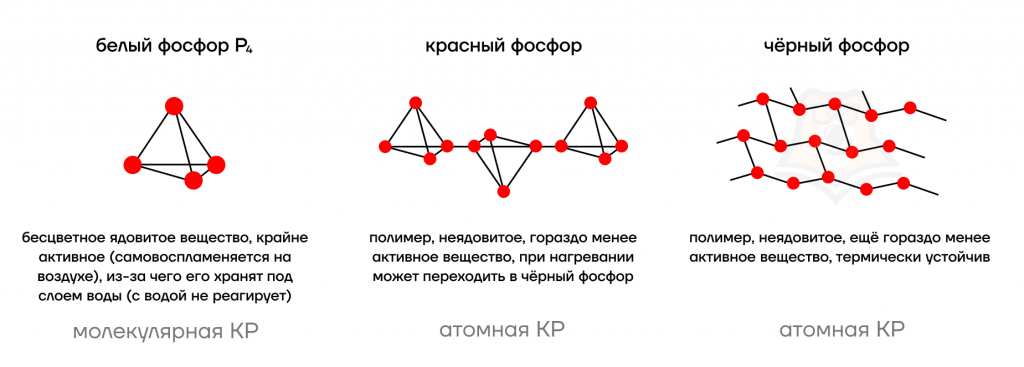
Фосфор как простое вещество, аналогично углероду, имеет несколько аллотропных модификаций.
О трех фосфорных братах
Можно запомнить основные свойства по “характерам” модификаций:
- Белый фосфор — токсичный взрывной парень, который отравляет всем жизнь и легком можно возгореться. Поэтому его от греха подальше упрятали под воду.
- Красный фосфор не очень ценит качества своего белого “брата”. Поэтому он неядовит и при высокой температуре просто превращается в любимого брата — в черный фосфор.
- Черный фосфор — полная противоположность белому, самый мирный брат из тройки. Он неядовит, фактически не реагирует на температуру. Дзен среди фосфоров.
Химические свойства
Фосфор имеет низкое значение электроотрицательности. Это значит, что фосфор проявляет ярко выраженные восстановительные свойства. Онплохо притягивает к себе электроны, поэтому у него их легко отобрать.
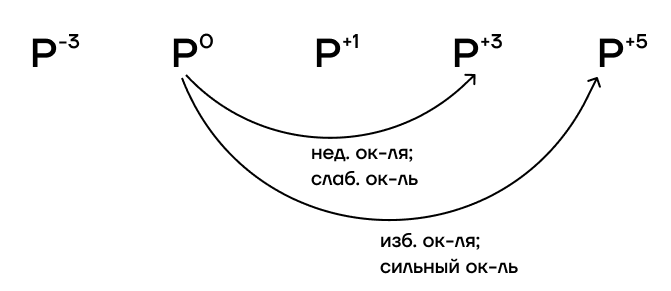
При избытке окислителя или воздействии такого сильного окислителя, как F2, фосфор переходит в степень окисления +5. При недостатке окислителя или воздействии такого слабого окислителя, как I2, фосфор переходит только в степень окисления +3.
- Реакции с простыми веществами
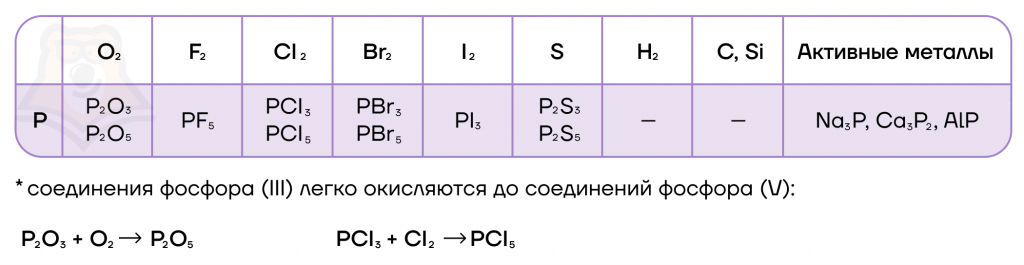
Как и многие бинарные соединения, галогениды фосфора способны гидролизоваться в различных средах (нейтральной, щелочной, кислой). Эти реакции мы, как и всегда, пишем по принципу «притяни плюс к минусу».
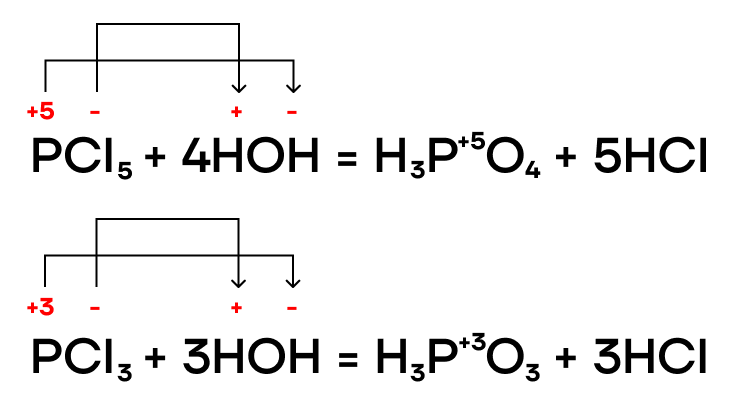
Фосфиды металлов также подвергаются гидролизу в разных средах.
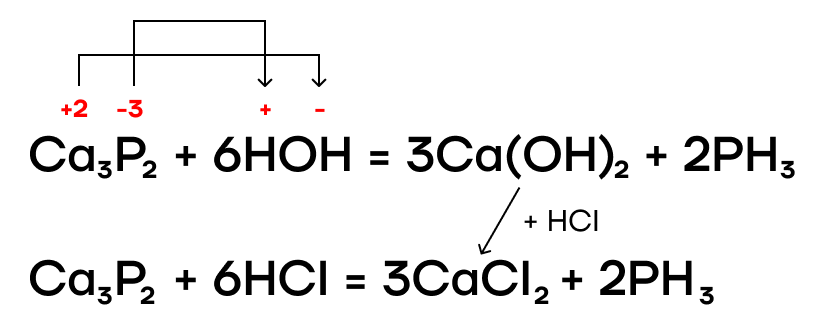
В результате протекания этих реакций образуется ядовитый газ с неприятным запахом чеснока (или тухлой рыбы) — фосфин PH3. Он проявляет очень слабые основные свойства.
За счет степени окисления фосфора -3 он проявляет ярко выраженные восстановительные свойства. Он богат, поэтому во время реакции можно его ограбить. Следовательно, способен взаимодействовать с окислителями.

- Реакция со щелочами
Фосфор — один из тех неметаллов, который способен взаимодействовать со щелочами (выражение для запоминания — «LiPSSi Ha»). Так как щёлочь не проявляет выраженных окислительных или восстановительных свойств, фосфору в этой реакции приходится отдуваться за двоих: играть роль как окислителя, так и восстановителя.
- Реакции с окислителями
Из-за низкой электроотрицательности фосфор является типичным восстановителем («жертвой»). Поэтому он способен взаимодействовать с окислителями. В ОВР он в подавляющем большинстве случаев как восстановитель повышает свою степень окисления до +5. Она является крайне устойчивой для него. Из-за этого соединения фосфора (V) не являются типичными окислителями, потому что фосфор не хочет уходить из любимой степени окисления.
Получение фосфора
В промышленности главным способом получения фосфора является спекание фосфорита (ортофосфата кальция) с диоксидом кремния и коксом. Для чего это делают?
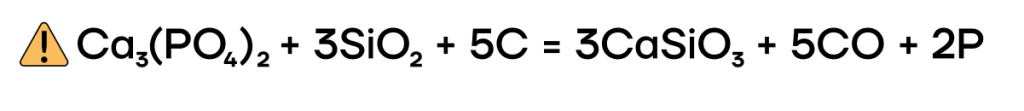
Оксид фосфора (III) P2O3 и фосфористая кислота H3PO3
Оксид фосфора (III) — типичный кислотный оксид. Это значит, он способен реагировать с водой с образованием соответствующей кислоты и вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами.
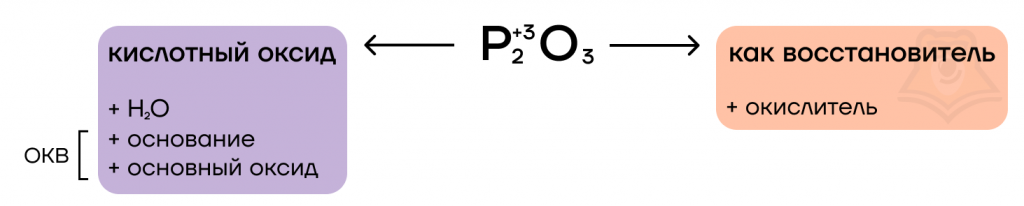
За счет степени окисления +3 оксид фосфора (III) проявляет восстановительные свойства, повышая в реакциях степень окисления до +5.
- Реакция с водой
Как типичный кислотный оксид, P2O3 способен взаимодействовать с водой с образованием соответствующего гидроксида (кислоты).
- Основно-кислотное взаимодействие
Тут все очень просто! P2O3 — кислотный оксид, он проявляет кислотные свойства. Значит, он способен вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами — с образованием солей.
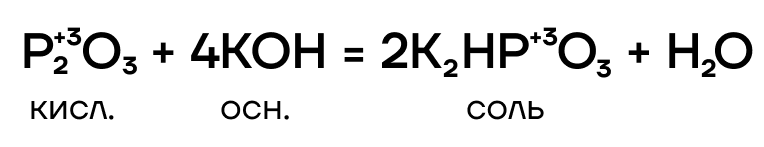
Оксид фосфора (V) P2O5
Оксид фосфора (V) P2O5 как типичный кислотный оксид будет реагировать с водой и вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами. Также как условно «сильный» оксид он способен вытеснять условно «слабые» из их солей при сплавлении.
- Реакция с водой
При взаимодействии с водой оксид фосфора (V) образует соответствующий гидроксид — ортофосфорную кислоту.

- Кислотно-основные реакции
Происходят с основаниями и основными оксидами. При этом образуются соли.
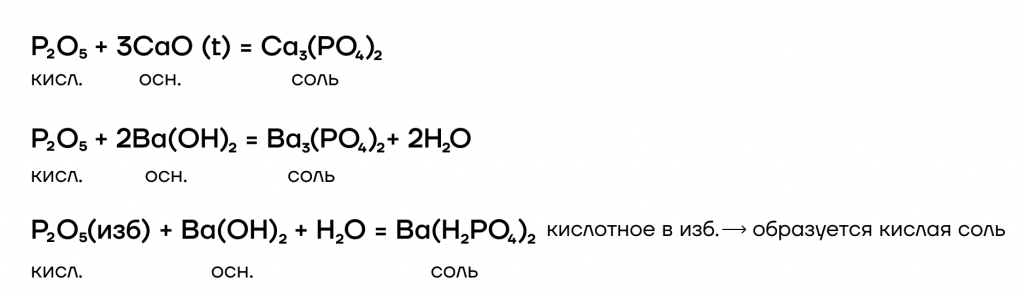
- Реакции вытеснения
В отношении реакций вытеснения P2O5 — это условно «сильный» оксид. Он способен вытеснять условно «слабые» (CO2 и SO2) из их солей при сплавлении (t).
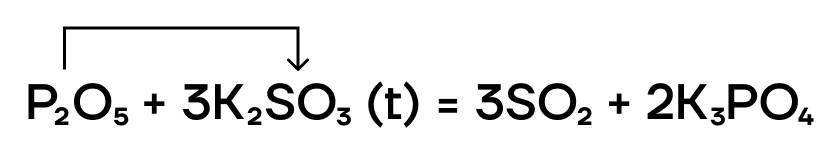
- P2O5-разбойник
Это вещество обладает крайне сильными дегидратирующими свойствами: оно активно осушает что?, отбирает воду. Он настолько жаден до воды, что может её отобрать даже у безводных кислородсодержащих летучих кислот.
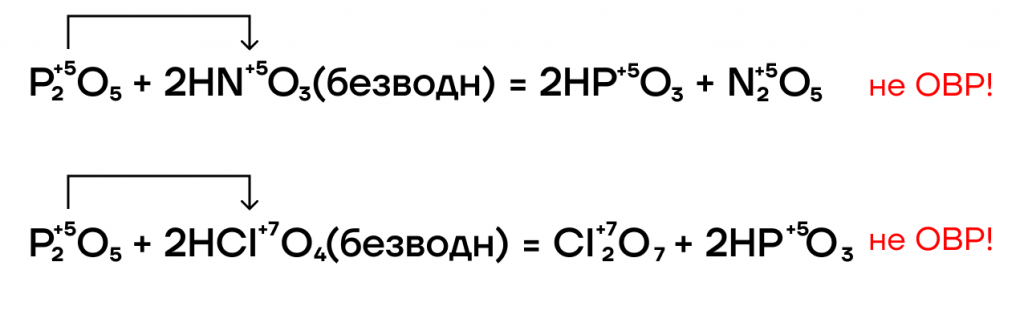
Ортофосфорная кислота H3PO4 и ортофосфаты
Ортофосфорная кислота — ничем не примечательная слабая кислота.
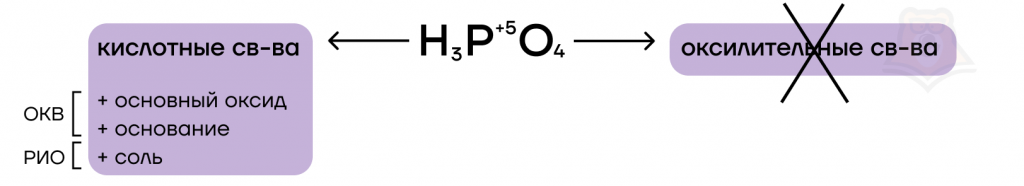
Как и все кислоты, она обладает кислотными свойствами. Она способна вступать в основно-кислотные взаимодействия с веществами, проявляющими основные свойства.
Опять же как и другие кислоты, она является электролитом. Это значит, она может распадаться на ионы и обмениваться ими с другими электролитами, то есть вступать в реакции ионного обмена.
Фактчек
- Фосфор — химический элемент VA-группы третьего периода; электронная конфигурация 1s22s22p63s23p3;
- Возможные степени окисления фосфора: -3, 0, +1, +3, +5;
- Существует несколько аллотропных модификаций фосфора: белый фосфор, черный фосфор, красный фосфор;
- Фосфор является типичным восстановителем в ОВР из-за низкой электроотрицательности;
- Фосфор образует следующие соединения: фосфин, оксиды, кислоты и соответствующие соли.
Проверь себя
Задание 1.
Количество электронов на внешнем энергетическом уровне атома фосфора равно:
- 3
- 4
- 5
- 6
Задание 2.
Какой аллотропной модификации фосфора не существует?
- Белый фосфор
- Желтый фосфор
- Черный фосфор
- Красный фосфор
Задание 3.
Фосфин можно получить реакцией:
- Фосфора и водорода
- Оксида фосфора(III) и водорода
- Оксида фосфора(V) и водорода
- Фосфора и раствора гидроксида калия
Задание 4.
Фосфористая кислота H3PO3 является:
- Трехосновной кислотой
- Двухосновной кислотой
- Одноосновной кислотой
- Четырехосновной кислотой
Ответы: 1. — 3; 2. — 2; 3. — 4; 4. — 2.
Существует три класса сложных неорганических соединений: оксиды, гидроксиды (к ним относятся кислоты и основания), а также соли. Многие металлы и неметаллы могут образовывать оксиды, гидроксиды, а также входить в состав кислотных остатков. Так, фосфор включается в кислотный остаток РО4. Существует несколько разновидностей оксида фосфора. Соответственно, есть различные его гидроксиды, которые из этих оксидов формируются. Высший гидроксид фосфора — это фосфорная кислота. В данной статье мы рассмотрим физические и химические свойства указанного элемента и его соединений, а также расскажем о его распространенности в природе и других интересных фактах.
Физические свойства фосфора
Он может существовать в разнообразных вариациях. Фосфор — вещество, которое состоит из одного химического элемента. Его атомы не объединяются в молекулы. Формула фосфора — Р. Однако в зависимости от строения кристаллической решетки, данный элемент может существовать в виде трех веществ.
Самым распространенным является белый фосфор — он обладает воскообразной структурой и высокой токсичностью. Температура плавления данного вещества составляет сорок четыре градуса по Цельсию, а кипения — двести восемьдесят градусов. При трении данного материала он очень быстро возгорается, поэтому режут его, только поместив в водную среду. Если на протяжении длительного времени нагревать его при температуре двести пятьдесят градусов по шкале Цельсия, он превращается в красный фосфор. Это вещество представлено в виде порошка буро-красного цвета. Красный фосфор, в отличие от белого, не является ядовитым.
Самой устойчивой формой существования данного элемента можно назвать черный фосфор, который по некоторым внешним признакам похож на металл: имеет своеобразный блеск, обладает высокой твердостью, электро- и теплопроводностью.
С точки зрения химии
Фосфор — химический элемент, который находится в пятой группе и третьем периоде в таблице Менделеева. Из этого можно сделать вывод, что валентность его равняется пяти. Кроме того, из периодической системы можно увидеть, что элемент фосфор имеет атомную массу, равную тридцати одному грамму на моль. Это значит, что 1 моль вещества будет весить 31 один грамм. Рассматривая химические свойства фосфора, мы поговорим о его реакциях с простыми, а также сложными соединениями.
Взаимодействие с простыми веществами
Первое, на что нужно обратить внимание, — окисление фосфора. Это его реакция с кислородом. В результате может быть образовано два различных вещества — все будет зависеть от пропорций указанных компонентов.
Первый вариант — из четырех молей фосфора и трех молей кислорода образуется два моля триоксида фосфора. Записать подобное химическое взаимодействие можно с помощью следующего уравнения: 4Р + 3О2 = 2Р2О3.
Второй вариант — это образование из четырех молей фосфора и пяти молей кислорода двух молей пентаоксида фосфора. Выразить данную реакцию можно с помощью следующего уравнения: 4Р + 5О2 = 2Р2О5.
При обеих химических реакциях происходит значительное выделение света. Кроме того, фосфор может взаимодействовать с такими простыми веществами, как металлы, галогены (фтор, йод, бром, хлор), сера. Данный химический элемент способен проявлять как восстановительные, так и окислительные свойства. Примером взаимодействия с галогенами может служить хлорирование. Оно происходит в два этапа. Первый — образование двух молей трихлората фосфора из двух молей рассматриваемого неметалла и трех молей хлора. Данное взаимодействие может быть выражено с помощью такого уравнения: 2Р +3Cl2= 2PCl3.
Второй этап данного процесса заключается в присоединении атомов хлора к уже полученному трихлорату фосфора. Так, при добавлении к одному молю последнего такого же объема хлора образуется один моль пентахлората фосфора. Записываем уравнение данной реакции таким образом: PCl3 + Cl2 = PCl5.
Закономерности взаимодействия фосфора с металлами можно рассмотреть на таком примере. Если взять три моля калия и один моль фосфора, получим один моль фосфида калия. Записать такого рода процесс можно при помощи следующего уравнения реакции: 3К + Р = К3Р.
Взаимодействие со сложными веществами
К сложным химическим соединениям, с которыми способен вступать в реакцию фосфор, относятся кислоты и соли. Опишем по порядку особенности контакта рассматриваемого элемента с данными группами химических веществ.
Фосфор и кислоты
Среди всех прочих особенно выделяется взаимодействие фосфора и азотной кислоты. Для проведения подобного рода реакции необходимо взять следующие компоненты: фосфор в количестве трех молей, пять молей нитратной кислоты, а также воду — два моля. В результате такого химического взаимодействия получим следующие продукты: фосфорную кислоту и оксид нитрогена. Записывается уравнение данной реакции следующим образом: 3Р + 5HNO3 + 3Н2О = 3Н3РО4 + 5NO.
Фосфор и соли
Подобного рода химические взаимодействия можно рассмотреть на примере реакции рассматриваемого неметалла с сульфатом купрума. Для проведения данного процесса необходимо взять два моля фосфора, пять молей сульфата меди, восемь молей воды. В результате взаимодействия данных веществ получим следующие химические соединения: сульфатную кислоту в количестве пять молей, чистую медь — столько же, а также фосфорную кислоту — два моля. Записать данный процесс можно в виде такого уравнения: 2Р + 5CuSO4 + 8Н2О = 5H2SO4 + 5Cu + 2Н3РО4.
Получение данного неметалла
В промышленности рассматриваемое вещество добывают из такого химического соединения, как фосфат кальция. Для этого осуществляется следующая химическая реакция: смешивают указанную соль с песком (оксидом кремния) и углеродом в молярных пропорциях 1:3:5, в результате получают силикат кальция, фосфор и чадный газ в молярном соотношении 3:2:5.
Соединения фосфора и их свойства
Самым распространенным из соединений рассматриваемого неметалла является гидроксид фосфора. Он может быть нескольких видов в зависимости от оксида, из которого формируется. Получить гидроксид фосфора можно при помощи проведения химической реакции между его оксидом и водой. Благодаря таким реакциям образуются разнообразные виды веществ. Так, из триоксида можно получить гидроксид (3), а из пентаоксида — гидроксид фосфора (5). Данные вещества обладают кислотными свойствами и способны, в свою очередь, вступать в реакции с металлами, солями, основаниями и др.
Высший гидроксид фосфора — это фосфорная кислота. Она является кислородосодержащей и трехосновной. Ее формула — Н3РО4.
Основные химические свойства
Гидроксид фосфора, формула которого приведена выше, способен реагировать как с простыми, так и со сложными веществами. Рассмотрим эти процессы подробнее.
Реакции фосфорной кислоты с металлами
Как и другие химические соединения данного класса, гидроксид фосфора способен вступать во взаимодействие с металлами. Во время данного процесса происходит реакция замещения, при которой атомы металлов вытесняют атомы гидрогена, тем самым образуя соль и водород, выделяющийся в воздух в виде газа с неприятным запахом. Для того чтобы данная реакция могла осуществиться, металл должен быть расположен левее водорода в электрохимическом ряду активности. То есть такие вещества, как медь, серебро и другие им подобные, не способны реагировать с фосфорной кислотой, так как в связи со своей низкой химической активностью они не смогут вытеснить атомы гидрогена из их соединений.
В качестве примера рассмотрим алюминий. При добавлении двух молей этого элемента к двум молям гидроксида фосфора мы получим фосфат алюминия и водород в количестве 2 и 3 молей соответственно. Уравнение данной реакции записывается следующим образом: 2Al + 2Н3РО4 = 2AlPO4 + 3Н2.
Взаимодействие с основаниями
Гидроксид фосфора, как и многие другие кислоты, может вступать в химические реакции с основаниями. Такие процессы называются реакциями обмена. В их результате формируется новый гидроксид, а также новая кислота. Подобного рода реакции могут осуществляться, только если один из получаемых продуктов является нерастворимым в воде, то есть выпадает в осадок, испаряется в виде газа либо является водой или очень слабым электролитом.
Фосфорная кислота и соли
В данном случае также происходит реакция обмена. В ее результате можно получить новую кислоту и соль. Для того чтобы осуществилась такого рода реакция, тоже должно соблюдаться правило, которое было описано чуть выше.
Применение фосфора и его соединений в промышленности
В первую очередь соединения данного химического элемента используют для изготовления смеси, которая наносится на боковую поверхность спичечных коробков. Также смесью с содержанием фосфора обрабатываются и сами головки спичек.
Пентаоксид рассматриваемого неметалла широко применяется в качестве осушителя газов. Также он используется в химической промышленности для того, чтобы получить гидроксид фосфора, формула и свойства которого были рассмотрены выше. Кроме того, его используют при изготовлении стекла.
Гидроксид фосфора также находит применение во многих отраслях промышленности. Прежде всего, он используется при изготовлении удобрений. Это связано с тем, что для растений фосфор просто жизненно необходим. Поэтому существует ряд разнообразных удобрений, которые изготавливаются на основе соединения рассматриваемого неметалла. Для этих целей используются такие вещества, как фосфат кальция. Соль применяют в качестве удобрения в молотом виде. Кроме того, для этого используют обыкновенный и двойной суперфосфат. В качестве удобрения могут служить также аммофос и нитроаммофос. Кроме всего вышеперечисленного, соли либо гидроксид фосфора используются в качестве реагента для определения наличия в растворе соединений серебра. Так, добавляют вещество, в состав которого входит кислотный остаток РО4, к раствору. Если в последнем присутствуют соли либо гидроксид серебра, выпадет осадок насыщенно-желтого цвета. Это фосфат аргентума, имеющий такую химическую формулу: AgNO3.
Строение атома фосфора
Как известно, все атомы состоят из ядра и электронов, вращающихся вокруг него. В ядре содержатся протоны и нейтроны. Электроны имеют отрицательный заряд, протоны — положительный, а нейтроны — нулевой. Порядковый номер фосфора в таблице Менделеева — пятнадцать. Из этого можно сделать вывод о том, что в его ядре содержатся пятнадцать протонов. Если же атом является нейтральным, а не ионом, то электронов столько же, сколько и протонов. То есть в случае с фосфором их пятнадцать.
Если один из электронов покинет свою орбиту, атом превратится в позитивно заряженный ион, то есть катион. Если же один электрон присоединится, образуется негативно заряженный ион — анион.
В периодической системе химических элементов можно увидеть, что фосфор относится к третьему периоду. Из этого понятно, что вокруг ядра имеется три орбиты, на которых равномерно распределены электроны. На первой расположено два, на второй — восемь электронов, а на третьей — пять.
Распространенность в природе
Массовая доля фосфора в земной коре составляет 0,08%. Он не является очень распространенным в природе химическим элементом. Однако существует целая группа минералов, в состав которых входит фосфор. Это апатиты, а также фосфориты. Самый распространенный из первой группы — фторапатит. Его химическая формула выглядит следующим образом: 3Ca3(PO4)2•CaF2. Он бывает прозрачного, зеленого и бирюзового оттенков. Среди фосфоритов больше всего распространен кальция фосфат, имеющий такую химическую формулу: Са3(РО4)2. Кроме того, соединения фосфора встречаются в составе тканей различных живых организмов.
Роль фосфора и его соединений в природе и организме
Данный химический элемент очень важен для нормального функционирования почти всех органов и их систем. В первую очередь без него невозможна бесперебойная работа почек. Данный элемент принимает участие в обменных процессах организма. Он также способствует скорейшей регенерации тканей. Без него некоторые витамины просто не могут активизироваться, чтобы дать пользу организму — вот почему практически во все витаминные препараты в качестве дополнительного компонента очень часто добавляют фосфор. Кроме того, это один из химических элементов, обеспечивающих нормальную работу сердца. Он, кроме всего вышеперечисленного, участвует в процессе деления клеток, поэтому без данного микроэлемента невозможна жизнь на Земле.
Регуляция водно-солевого баланса — еще одна функция, которую выполняют в организме соединения рассматриваемого в данной статье неметалла. Кроме того, он является одной из главных составляющих костной и мышечной ткани. Большой его процент содержится и в зубах. Помимо всего прочего, стоит также отметить, что фосфор участвует в обеспечении нормальной работы нервной системы. Симптомы недостатка в организме рассматриваемого микроэлемента следующие: повышенная утомляемость, низкая работоспособность, нарушения в работе нервной системы (неврозы, истерия и т.п.), слишком частые простуды, истощение сердечной мышцы, боль в костях и мышцах, очень слабый аппетит. Чтобы избежать такого явления, как недостаток фосфора в организме, необходимо знать, в каких же продуктах он содержится.
Прежде всего среди продуктов, богатых рассматриваемым химическим элементом, следует выделить рыбу. Особенно высокая концентрация фосфора наблюдается в таких видах, как осетр, скумбрия, ставрида, тунец, сардина, мойва, минтай, корюшка. Кроме того, рассмотренный в данной статье микроэлемент содержится в крабовом мясе, креветках, а также в молочных продуктах, таких как творог, плавленый сыр, брынза.
Выводы
Фосфор хоть и не является очень распространенным на планете химическим элементом, но имеет огромное значение как с промышленной, так и с биологической точки зрения. Он и его соединения, в частности, гидроксид фосфора, используются при производстве разного рода продукции. В статье также были описаны свойства гидроксида фосфора (фосфорной кислоты) и особенности его взаимодействия с металлами, основаниями и солями.