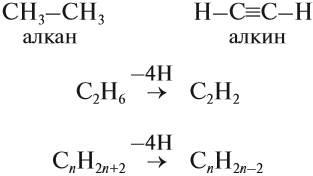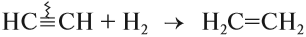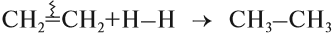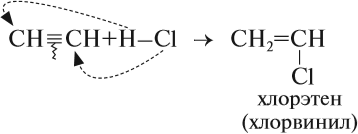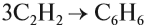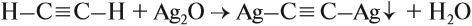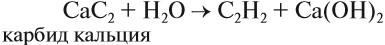Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Строение, изомерия и гомологический ряд алкинов
Химические свойства алкинов
Получение алкинов
Гомологический ряд алкинов
Все алкины имеют общие или похожие физические и химические свойства. Схожие по строению алкины, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкины образуют гомологический ряд.
Первый представитель гомологического ряда алкенов – этин (ацетилен) C2H2, или СH≡СH.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкина | Формула алкина |
| Этин (ацетилен) | C2H2 |
| Пропин | C3H4 |
| Бутин | C4H6 |
| Пентин | C5H8 |
| Гексин | C6H10 |
| Гептин | C7H12 |
Общая формула гомологического ряда алкинов CnH2n-2.
Первые три члена гомологического ряда алкинов – газы, начиная с C5Н8 по С16Н30 – жидкости, начиная с С17Н32 — твердые вещества.
Алкины плохо растворимы в воде и хорошо растворимы в органических растворителях.
Строение алкинов
Рассмотрим особенности строения алкинов на примере ацетилена.
В молекуле ацетилена присутствуют химические связи C–H и С≡С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С≡С – тройная, ковалентная неполярная, одна из связей σ, еще две: π-связи. Атомы углерода при тройной связи образуют по две σ-связи и две π-связи. Следовательно, гибридизация атомов углерода при тройной связи в молекулах алкинов – sp:
При образовании σ-связи между атомами углерода происходит перекрывание sp-гибридных орбиталей атомов углерода:
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Две sp-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому две гибридные орбитали атомов углерода при тройной связи в алкинах направлены в пространстве под углом 180о друг к другу:
Изображение с сайта orgchem.ru
Это соответствует линейному строению молекулы.
Например, молекуле ацетилена C2H2 соответствует линейное строение.
Изображение с сайта orgchem.ru
Молекулам алкинов с большим числом атомов углерода соответствует пространственное строение.
Например, в молекуле пропина присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение.
Изомерия алкинов
Для алкинов характерна структурная и пространственная изомерия.
Структурная изомерия
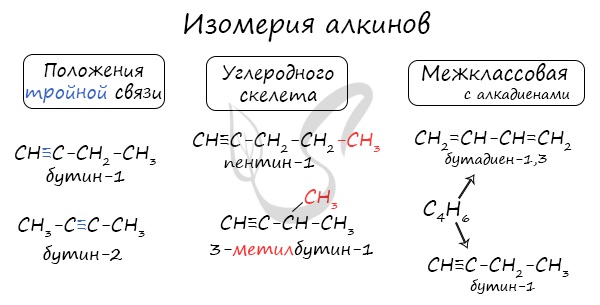
Для алкинов характерна изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры с различным углеродным скелетом и с формулой С4Н6 — бутин-1 и бутадиен-1,3
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкины являются межклассовыми изомерами с алкадиенами. Общая формула алкинов и алкадиенов — CnH2n-2.
Межклассовые изомеры с общей формулой С4Н6 — бутин-1 и бутадиен
Изомеры с различным положением тройной связи отличаются положением тройной связи в углеродном скелете.
Изомеры положения тройной связи, которые соответствуют формуле С5Н8 — пентин-1 и пентин-2
Пространственная изомерия
Для алкенов также характерна оптическая изомерия.
Алкины, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкина должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия для алкинов не характерна, так как по тройной связи вращение возможно.
Номенклатура алкинов
В названиях алкинов для обозначения тройной связи используется суффикс -ИН.
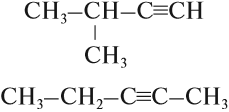
Например, алкин на рисунке называется бутин-2
Для простейших алкинов применяются также исторически сложившиеся (тривиальные) названия:
| Название алкина | Формула алкина |
| Ацетилен | CH≡CH |
| Пропин | CH≡C−CH3 |
| Бутин-1 | CH≡C−СH2−CH3 |
Радикалы, содержащие тройную связь, также носят тривиальные названия:
| Формула радикала | Тривиальное название |
| CH≡C− | этинил |
| CH≡C−CH2− | пропаргил |
Химические свойства алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкинов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С≡С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С–С | 348 | 0,154 |
| С≡С | 814 | 0,120 |
| С–Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С, поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С≡С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан.
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1.
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь.
Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан.
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
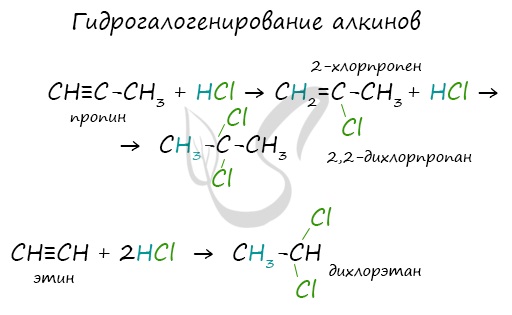
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан.
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен.
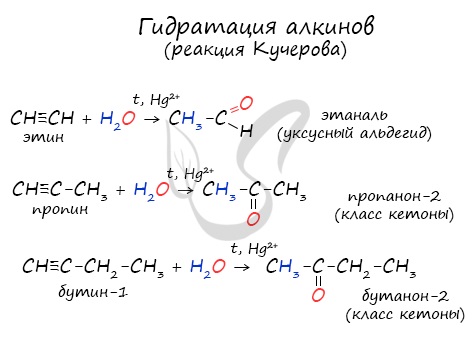
1.4. Гидратация алкинов
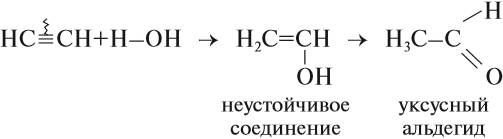
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид.
Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
Например, при гидратации пропина образуется пропанон (ацентон).
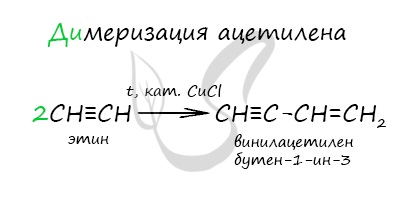
1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
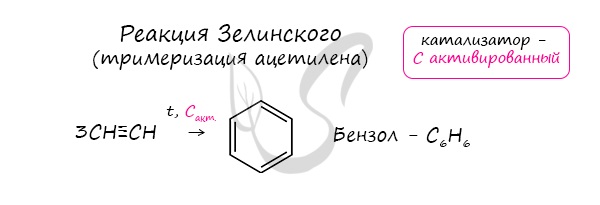
Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Например, при полимеризации ацетилена образуется полимер линейного или циклического строения.
… –CH=CH–CH=CH–CH=CH–…
2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
Например, уравнение сгорания пропина:
C3H4 + 4O2 → 3CO2 + 2H2O
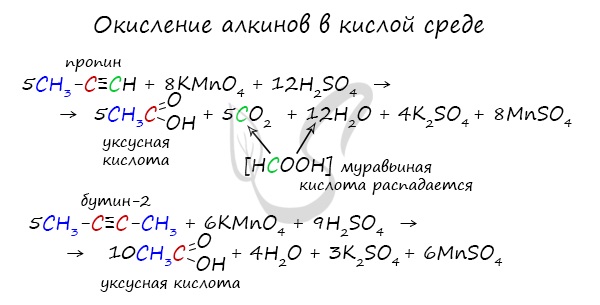
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C≡ | R-COOH | -COOMe |
| CH≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C≡, поэтому образуется уксусная кислота:
При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:
При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C≡, поэтому образуется соль уксусной кислоты – ацетат калия
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp2 и sp3-гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp2 | sp3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н+, т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
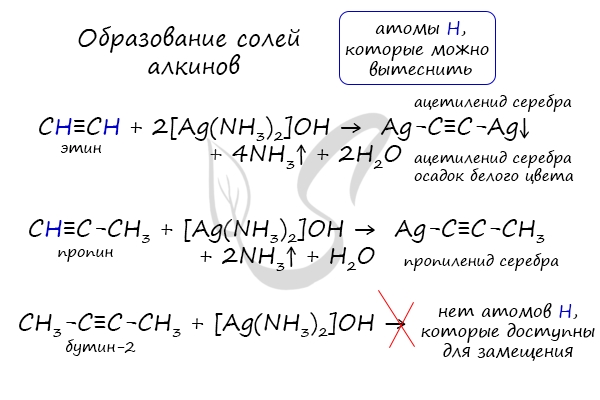
Ацетилен и его гомологи с тройной связью на конце молекулы R–C≡C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов.
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия.
Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия.
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы.
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Получение алкинов
1. Дегидрирование алканов
При дегидрировании алканов, содержащих от двух до трех атомов углерода в молекуле, образуются двойные и тройные связи.
Например, при дегидрировании этана может образоваться этилен или ацетилен:
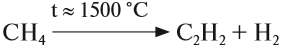
2. Пиролиз метана
Пиролиз метана – это промышленный способ получения ацетилена.
Реакцию проводят, очень быстро пропуская метан между электродами (электродуговой способ) — примерно 0,1-0,01 секунды при температуре 1500оС.
Если процесс проводить дольше, то метан разлагается на углерод и водород:
3. Гидролиз карбида кальция
Лабораторный способ получения ацетилена – водный или кислотный гидролиз карбида кальция CaC2.
СаС2 + 2Н2О = Са(ОН)2 + С2Н2
В кислой среде образуется ацетилен и соответствующая соль:
CaC2 + 2HCl = CaCl2 + C2H2
Карбид кальция можно получить, нагревая оксид кальция с углеродом:
СаО + 3С (изб) → СаС2 + СО
4. Дегидрогалогенирование дигалогеналканов
Дигалогеналканы, в молекулах которых два атома галогена расположены у одного, либо у соседних атомов углерода, реагируют с избытком спиртового раствора щелочей с образованием алкинов.
Например, 1,2-дихлорпропан реагирует со спиртовым раствором гидроксида натрия
1,1-дихлорпропан реагирует со спиртовым раствором щелочи с образованием пропина.
5. Алкилирование соединений алкинов с металлами
Ацетилениды, пропиниды и прочие соединения алкинов с металлами реагируют с галогеналканами с образованием гомологов алкинов. При этом происходит удлиннение исходной молекулы алкина.
Например, пропинид натрия реагирует с бромэтаном с образованием пентина-2
Алкины — это непредельные (ненасыщенные) углеводороды с одной тройной связью в молекуле.
Общая формула алкинов —
CnH2n−2
. Гомологический ряд начинается с ацетилена (этина), состав которого
C2H2
. В молекулах всех алкинов есть одна тройная связь, а состав каждого следующего гомолога отличается от предыдущего на группу
CH2
.
Согласно правилам международной номенклатуры, названия алкинов образуются с изменением в названиях соответствующих алканов суффикса «ан» на «ин». Положение тройной связи указывают цифрой.
Формулы и названия некоторых гомологов ацетилена приведены в таблице.
|
Название алкина |
Молекулярная формула |
Структурная формула |
|
Этин (ацетилен) |
C2H2 |
CH≡CH |
|
Пропин |
C3H4 |
CH≡C−CH3 |
|
Бутин-(1) |
C4H6 |
CH≡C−CH2−CH3 |
|
Пентин-(1) |
C5H8 |
CH≡C−C3H7 |
|
… |
… |
… |
|
Нонин-(1) |
C9H16 |
CH≡C−C7H15 |
|
Децин-(1) |
C10H18 |
CH≡C−C8H17 |
Строение гомологов ацетилена
В молекулах алкинов два атома углерода, соединённые тройной связью, находятся в состоянии
sp
-гибридизации. Углы между связями составляют (180°), длина тройной углерод-углеродной связи равна (0,120) нм. Четыре атома располагаются на одной линии.
Остальные атомы углерода в молекулах алкинов находятся в
sp3
-гибридном состоянии. Валентные углы у этих атомов (109°), а длина одинарных связей между атомами углерода равна (0,154) нм (как у алканов).
Алкины, как и алкены, относятся к ненасыщенным углеводородам.
Алкины
представляют собой углеводороды, содержащие в составе молекул тройную связь.
Алкины
в природе практически не встречаются, за исключением ацетилена, который образуется
в незначительных количествах при созревании яблок. Некоторые алкины содержатся в масле ромашки, в некоторых видах
грибов, феромонах насекомых, в морских организмах –
губках. Алкины входят в состав токсичного вещества,
которое применяли для смазывания наконечников стрел индейцы Амозонки.
Орбитали
атомов углерода, между которыми образована тройная связь, находятся в
состоянии sp-гибридизации. Это означает, что в
гибридизации участвует одна s- и одна р-орбиталь,
а две р-орбитали остаются негибридизованными.
Перекрывание гибридных орбиталей приводит к
образованию σ-связи, а за счёт негибридизованных р-орбиталей соседних атомов углерода образуются
две π-связи.
То
есть, тройная связь состоит из одной σ- и двух π-связей. Все
гибридные орбитали атомов, между которыми образована
тройная связь, находятся на одной линии, а плоскости π-связей
перпендикулярны друг другу.
Тройная
углерод-углеродная связь, длина которой 0,12 нм,
короче двойной. Энергия тройной связи больше, то есть она является более
прочной. Таким образом, молекула ацетилена имеет линейное строение и
валентный угол связей 1800.
Рассмотрим
гомологический ряд алкинов. Первый представитель
гомологического ряда алкинов – этин,
или ацетилен, второй представитель – пропин, третий –
бутин-1, четвёртый – пентин-1.
CH ≡ CH
CH ≡ C – CH3
CH ≡ C – CH2
– CH3
CH ≡ C – CH2
– CH2 – CH3
Общая формула алкинов CnH2n-2.
Названия
алкинов образуются с заменой суффикса-ан в названии
соответствующего насыщенного углеводорода на суффикс -ин. Например, название
этана заменяется на этин, пропана – на пропин.
CH
≡
CH
CH3 – C
≡ CH
То
есть, наличие тройной связи в молекулах углеводородов этого класса отражается
суффиксом -ин, а её положение в цепи — номером атома углерода.
При
составлении названия алкина выбирается самая длинная
цепь, включающая тройную связь; нумерация цепи идёт с того конца, к которому
ближе находится кратная связь; её местоположение указывается наименьшим из двух
номеров углеродным атомом. Если тройная связь находится на одинаковом
расстоянии от концов цепи, нумерацию ведут с того конца, к которому ближе
находится заместитель. Например:
Если
в молекуле имеются двойная и тройная связи, начало нумерации определяет двойная
связь, и сначала помещают суффикс -ен, а после него –
-ин. Например:
Радикал,
образованный от ацетилена (HC≡C−), называется этинил.
Алкины с
концевой тройной связью (ацетилен, пропин, бутин-1 и
другие) называют терминальными ацетиленовыми углеводородами.
Для
алкинов характерны все виды структурной изомерии: изомерия
углеродного скелета, изомерия положения тройной связи. Рассмотрим
различные виды изомерии на примере алкина с
молекулярной формулой С5Н8. Его изомером будет
3-метилбутин-1, и если это изомерия положения тройной связи, то его изомерами
будут пентин-1 и пентин-2.
Так
как тройная связь предполагает линейное строение углеродной цепи,
геометрическая (цис-, транс )
изомерия в случае алкинов невозможна.
Алкинам изомерны соединения некоторых других классов. Так,
химическую формулу С6Н10 имеют гексин
(алкин), гексадиен (алкадиен) и циклогексен (циклоалкен).
Алкины — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С.
Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи).
Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда — этин — CH≡CH (ацетилен).
Общая формула их гомологического ряда — CnH2n-2.
Номенклатура и изомерия алкинов
Названия алкинов формируются путем добавления суффикса «ин» к названию алкана с соответствующим числом: этин, пропин, бутин и т.д.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация
атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых
начинается тройная связь.

Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами.
Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи,
соединен только с одним единственным заместителем.
Некоторые данные, касающиеся алкинов, надо выучить:
- В молекулах алкинов присутствуют тройные связи, длина которых составляет 0,121 нм
- Тип гибридизации атомов углерода — sp
- Валентный угол (между химическими связями) составляет 180°
Получение алкинов
Ацетилен получают несколькими способами:
- Пиролиз метана
- Синтез Бертло
- Разложение карбида кальция
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород.
2CH4 → (t) CH≡CH + 3H2
Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода.
2C + H2 → (t, вольтова дуга) CH≡CH
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II.
CaC2 + 2H2O → CH≡CH + Ca(OH)2
Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена
расположены у одного атома углерода или у двух соседних атомов.

Химические свойства алкинов
Алкины — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Реакция Кучерова
- Окисление
- Реакция Н.Д. Зелинского (тримеризация ацетилена)
- Димеризация ацетилена
- Образование солей алкинов
Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь).
CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода)
CH2=CH-CH3 + H2 → (t, Ni) CH3-CH2-CH3 (в реакции участвует 1 моль водорода)
CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода)
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная
вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.

Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а
атом галогена — к наименее гидрированному атому углерода.
Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским
химиком М.Г. Кучеровым в 1881 году. Катализатор — соли ртути Hg2+.
Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются
кетоны.
При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды — полное окисление.
2CH≡CH + 5O2 → 4CO2 + 2H2O
Сильные окислители (особенно в подкисленной среде) способны разрывать молекулы алкинов в самом слабом месте — в месте тройной связи.
Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на
углекислый газ и воду.
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический
углеводород — бензол.
Димеризация ацетилена происходит при наличии катализатора — солей меди I. В результате реакции две молекулы ацетилена соединяются,
образуя винилацетилен.
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла.
Если тройная связь спрятана внутри молекулы, то образование солей невозможно.
Реакция аммиачного раствора серебра и ацетилена — качественная реакция, в ходе которой выпадает осадок ацетиленида серебра.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Содержание
- Определение. Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства алкинов
- Физические свойства
- Химические свойства
- Получение и применение ацетилена
- Выводы
Определение. Гомологический ряд, номенклатура, изомерия
Алкины — это нециклические углеводороды, в молекулах которых есть одна тройная связь, а остальные связи простые.
Алкины относят к группе непредельных ненасыщенных углеводородов. Для того чтобы вывести общую формулу гомологического ряда алкинов, сравним состав алканов и алкинов:
Таким образом, алкины образуют гомологический ряд, общая формула которого
Вопрос. Какие ещё углеводороды имеют такую же общую формулу гомологического ряда?
Значит, алкины и алкадиены с одинаковым числом атомов углерода являются изомерами.
Первый член гомологического ряда С2Н2 называется ацетилен. Поэтому алкины относятся к ацетиленовым углеводородам.
Вопрос. Почему в названиях ацетиленовых углеводородов появился суффикс ИН? (См. урок 17.7.)
Задание 20.1. Составьте молекулярную и графическую формулы алкина с n = 4.
Выполнив последнее задание, вы убедитесь, что для этого алкина можно составить две графические формулы:
Значит, изомерия алкинов связана с положением тройной связи в молекуле. Кроме того, изомерия связана со строением углеводородного радикала:
Задание 20.2. Составьте молекулярные формулы этих соединений и убедитесь, что это изомеры. Назовите эти вещества.
Запомните:
- названия алкинов составляют, используя суффикс ИН;
- нумерацию основной цепи ведут с того конца, к которому ближе тройная связь.
Строение молекул
В состав молекулы любого алкина входит одна тройная связь, поэтому особенности свойств этих соединений будут связаны с особенностями тройной связи. Это сложная, неоднородная связь. Её составляют одна простая σ-связь и две π-связи.
Вопрос. Какая из этих связей легче разрушается в химических реакциях? Почему?
Значит, как и у алкенов, в химических реакциях будет прежде всего разрушаться менее прочная π-связь. Алкины тоже легко вступают в химические реакции, но, в отличие от алкенов, большинство реакций за счёт π-связи идут в две стадии: сначала разрывается одна π-связь, потом вторая π-связь. Характерной реакцией является реакций присоединения, хотя возможны и другие типы реакций.
Свойства алкинов
Физические свойства
По физическим свойствам алкины мало отличаются от алкенов и алканов. Так, простейший алкин ацетилен — газ без вкуса и запаха, плохо растворимый в воде. Среди гомологов ацетилена есть и жидкие, и твёрдые вещества: чем больше молекулярная масса, тем выше температуры кипения и плавления алкинов.
Химические свойства
Для алкинов, как и для алкенов, характерны реакции присоединения. Они идут в две стадии:
Вопрос. Возможна ли для полученного соединения реакция присоединения?
Поскольку полученный этилен содержит двойную связь, возможна вторая стадия этого процесса:
Вопрос. Возможна ли реакция присоединения для полученного вещества? Почему?
Таким образом, в результате реакции гидрирования из ацетилена можно получить и этилен, и этан. Всё зависит от условия процесса и от соотношения исходных веществ. Например, реакцию присоединения хлороводорода к ацетилену часто прерывают на первой стадии:
Дело в том, что хлорвинил применяется для получения полимера полихлорвинила.
Задание 20.3. Составьте уравнения реакции полимеризации хлорвинила.
Изделия из полихлорвинила (–СНСl–СН2–)n имеют разнообразное применение.
Так, полихлорвинил (ПХВ, или ПВХ) является основой для получения искусственной кожи, различной посуды одноразового пользования, полимерной тары, клеёнок, отделочных материалов и т. д. Многие пластмассовые изделия, которые мы используем каждый день, обивка салонов автомобилей, вагонов, самолётов, — сделаны из ПВХ. Он также используется для электроизоляции проводов.
Аналогично идут и другие реакции присоединения. Например, ацетилен, как и этилен, обесцвечивает бромную воду. Кроме того, он обесцвечивает и раствор перманганата калия, т. е. вступает в реакции окисления.
Задание 20.4. Составьте уравнения реакции ацетилена с бромом.
Таким образом, ацетилен тоже даёт качественные реакции на π-связь. Поэтому правильнее говорить, что реакции обесцвечивания бромной воды и перманганата калия — это качественные реакции на кратную связь. Другими словами, при помощи этих реакций можно обнаружить непредельные соединения, содержащие кратную связь, которая содержит π-связь.
Большое практическое значение имеет реакция присоединения воды к ацетилену — гидратация ацетилена. Поскольку эту реакцию открыл и изучил российский ученый М. Г. Кучеров*, она носит название «реакция Кучерова»:
* Кучеров Михаил Григорьевич (3.06.1850–26.06.1911) — русский химик-органик. Открыл (1881) реакцию каталитической гидратации ацетиленовых углеводородов с образованием карбонилсодержащих соединений.
Уксусный альдегид нужен для получения уксусной кислоты. Ацетилен горит.
Задание 20.5. Составьте уравнение реакции горения ацетилена.
Газообразные углеводороды можно различить по характеру пламени. Так, метан горит бесцветным пламенем, этилен — светящимся, а ацетилен — коптящим, т. е. углерод окисляется не полностью и частично выделяется в виде простого вещества (сажи). В токе кислорода ацетилен горит ослепительно-голубым пламенем с выделением большого количества теплоты (температура пламени превышает 3000 °C!). Поэтому эта реакция используется для газовой сварки и резки металлов.
При неполном окислении ацетилена (раствором перманганата калия) образуется смесь кислот.
Для ацетилена возможна реакция полимеризации, причём в эту реакцию может вступать небольшое число молекул. Так, при тримеризации ацетилена (соединяются три молекулы) образуется циклическое соединение — бензол:
Для алкинов характерна подвижность атомов водорода у тройной связи. За счёт этих атомов происходят реакции замещения таких атомов водорода:
Аналогичная реакция замещения происходит и с оксидом меди (I), и со щелочными металлами. В результате обеих реакций выделяется осадок, поэтому их считают качественными реакциями на алкины, в молекулах которых имеется атом водорода у тройной связи. Такая же реакция замещения происходит и со щелочными металлами.
Получение и применение ацетилена
Ацетилен в небольших количествах входит в состав природных газов. Его получают крекингом метана:
В небольших количествах, например для сварки металлов и в лаборатории, его получают из карбида кальция:
Ацетилен, полученный карбидным способом, используется для сварки и резки металлов, поскольку температура пламени автогена (горение ацетилена в кислороде) достигает 3000 °C.
Ацетилен и его производные используются для получения пластмасс, каучуков, уксусной кислоты, растворителей.
Выводы
Алкины — это непредельные углеводороды, содержащие тройную связь. Для таких веществ характерны реакции:
- присоединения;
- окисления;
- полимеризации. Все они происходят за счёт разрыва π-связи, которая входит в состав тройной связи;
- замещения атома водорода у тройной связи.