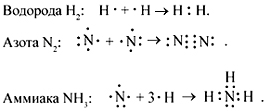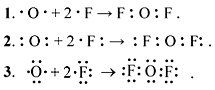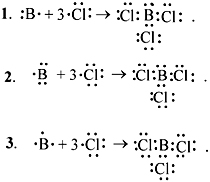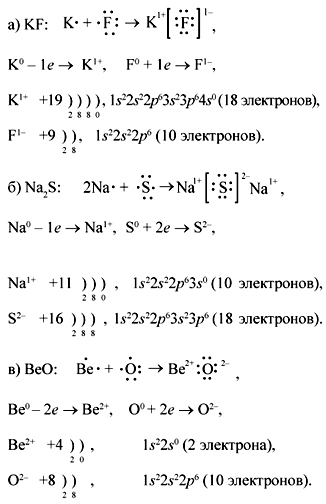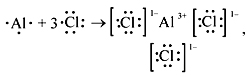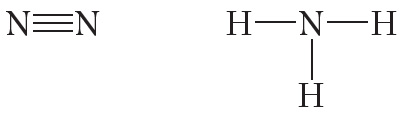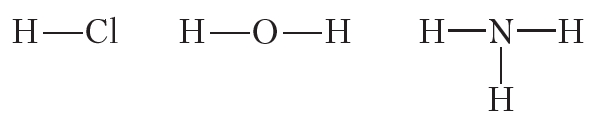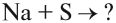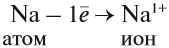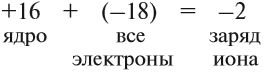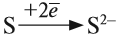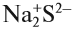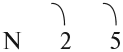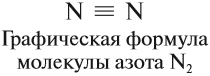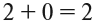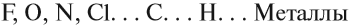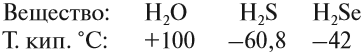План урока
Дисциплина:
Химия
Урок № 72
Преподаватель:
Аметова Ульвие Юнусовна
Дата:
28.02.19 02.03.19
Группа:
12 11
Тема урока: Ковалентная
химическая связь. Составление формул. Свойства веществ.
Тип
урока: изучение и закрепление
нового материала.
Вид
урока: урок-дискуссия
Методы
обучения: словесный, наглядный,
объяснение.
Цель
урока:
Образовательные:
Ø изучить виды
ковалентной связи (полярная и неполярная);
Ø изучить механизм
образования ковалентной химической связи;
Ø научиться
составлять электронные формулы молекул бинарных соединений;
Ø систематизировать
и обобщить знания учащихся о ковалентной химической связи;
Ø продолжить
формирование интереса к химии;
Развивающие:
Ø создание условий
для развития приемов мышления (анализ, синтез, обобщение, классификация), развитие
коммуникационных умений;
Ø закрепить знания
учащихся о распределении электронов в атоме;
Ø формировать
умения определять вид ковалентной связи;
Ø формировать
умения написания электронных формул бинарных соединений;
Ø развивать навыки
аналитического мышления;
Ø развитие
самостоятельности, памяти, внимания, логического мышления, умения анализировать
и систематизировать, самостоятельно делать выводы посредством обобщений.
Воспитательные:
Ø воспитывать
умение работать в сотрудничестве, оказывать взаимовыручку и взаимопомощь;
Ø создание условий
для воспитания активности и самостоятельности, убежденности в познаваемости
мира;
Ø воспитывать
культуру научного труда; повышать интерес к проблемам современной науки;
Ø формирование эстетического
чувства при аккуратном заполнение тетрадей;
Межпредметные связи (МПС): физика.
ТСО и наглядные пособия: учебник химии, периодическая таблица Д.И. Менделеева, таблицы «Механизмы образования ковалентной химической связи»,
«Молекула водорода», «Электроотрицательность», алгоритм составления схемы
ковалентной связи.
Ход
урока
1.
Организационный момент.
Приветствие. Проверка готовности к
уроку. Проверка присутствующих.
2.
Актуализация опорных знаний.
Что мы изучали на прошлом уроке? Вспомним
основные понятия.
— Фронтальный опрос.
— Что такое лантаноиды и актиноиды? Где
они расположены в периодической таблице Д.И. Менделеева?
— Какие подуровни появляются у элементов
данных рядов?
— Что такое провал электрона? Приведите примеры,
у каких элементов это возможно?
— Сколько энергетических уровней будет у
элементов 4-7 периодов? Сколько электронов на внешнем уровне содержат элементы
побочных подгрупп?
3. Формирование новых понятий
и способов действий, формирование навыков умственного труда.
— Ребята, как вы считаете, что важно знать
при составлении химических формул?
Ответ: вид химической связи.
Учитель: запишите тему урока: «Ковалентная
химическая связь. Составление формул. Свойства веществ.»
Учитель: Какие виды химической связи вам
известны?
Студенты: ковалентная связь, ионная,
металлическая, водородная связи.
Учитель: А что такое химическая связь?
— Химическая связь
– это такое взаимодействие атомов,
которое связывает их в молекулы, ионы, радикалы, атомы.
Причиной образования химической связи
между частицами является стремление системы к минимуму энергии. Энергия
образующейся системы – химической связи – меньше энергии, которой обладают
изолированные частицы. Идет выигрыш энергии.
Учитель: А какие
частицы образуются за счет ковалентной связи?
Студенты: атомы, молекулы.
Учитель: Совершенно
точно и вы должны помнить, что синонимом ковалентной связи является атомная
химическая связь.
Атомная или
ковалентная химическая связь — взаимодействие атомов, энергия которых находится
в пределах от нескольких десятков до примерно 1000 кДж/моль. Однако,
энергетический критерий еще не дает возможность отличить химическую связь от
других взаимодействий, например от межмолекулярного, энергия которого может достигать
80 кДж/моль. Поэтому будет правильнее определить ковалентную химическую
связь как перестройку электронных оболочек связывающихся атомов путем
обобществления их валентных электронов. Результатом этого процесса является
образование из атомов молекул, радикалов, кристаллов. Подумайте и вспомните,
какие химические элементы в природных условиях находятся в состоянии
одноатомных газов?
Вы также должны
помнить, с чем это связано?
Правильно, поэтому
логично предположить, что атомы других химических элементов будут стремиться
приобрести конфигурацию благородного газа, т.е. наиболее стабильную. Это
возможно достичь путем образования общих электронных пар, принадлежащих
соединяющимся атомам и взаимодополняющих их электронные орбитали до устойчивой
конфигурации типа 1s2 или ns2np6 ,
т.е. с помощью ковалентной связи.
Каждый атом стремится
завершить свой внешний электронный уровень, чтобы уменьшить потенциальную
энергию. Поэтому ядро одного атома притягивается к себе электронную плотность
другого атома и наоборот, происходит наложение электронных облаков двух
соседних атомов.
Учитель: записать в тетради основные определения.
Ковалентная связь –
это связь, образованная между двумя неметаллами, возникающая между атомами за
счет образования общих электронных пар. (Например: H2, HCl, H2O).
По степени
смещённости общих электронных пар к одному из связанных ими атомов ковалентная
связь может быть полярной и неполярной.
Запишите: ковалентная связь
делится на полярную и неполярную связь.
Учитель: важнейшим
фактором характеристики атома при образовании химической связи является его
электроотрицательность. Вспомним что такое электроотрицательность?
Электроотрицательность (ЭО) — это свойство атомов одного элемента притягивать к себе
электроны от атомов других элементов.
Учитель: Какой самый электроотрицательный химический элемент?
Студент: Самый электроотрицательный элемент – фтор F.
Совершенно верно. За
1 приняли электроотрицательность атома лития, а далее по периоду слева на
направо она увеличивается.
Электроотрицательность
можно выразить количественно и выстроить элементы в ряд по ее возрастанию.
Наиболее часто используют ряд электроотрицательности элементов, предложенный
американским химиком Л. Полингом.
Учитель: вот
вам таблица с электроотрицательностью элементов. Давайте проанализируем ее?
— Как меняются значения
электроотрицательности в периодической системе по периоду и подгруппе?
— (Вывод: Металлы имеют более
низкое значение электроотрицательности, чем неметаллы. И между ними она сильно
отличается.)
— Если связь
образуется между двумя одинаковыми атомами или между атомами с одинаковым
значением ЭО, то смещения общей электронной пары нет и такая связь носит
название неполярной.
Учитель:
запись в тетрадь.
КОВАЛЕНТНАЯ
НЕПОЛЯРНАЯ СВЯЗЬ (КНС) — образуют
атомы одного и того же химического элемента — неметалла (Например: H2,
O2, О3). Атомы между которыми происходит образование
связи, обладают равной ЭО.
Механизм образования
связи.
(Составление электронных
формул молекул простых веществ неметаллов)
Каждый атом неметалла
отдает в общее пользование другому атому наружные не спаренные электроны.
Образуются общие электронные пары. Электронная пара принадлежит в равной мере
обоим атомам.
Рассмотрим механизм
образования молекулы хлора:Cl2 –
кнс.
Электронная схема образования
молекулы Cl2:
Структурная формула молекулы
Cl2:.
Cl – Cl , σ (p – p) —
одинарная связь
Образование молекулы
водорода
Атомы образуют связь,
осуществляемую общей для них электронной парой, для достижения наиболее
стабильной электронной конфигурации, которая может быть представлена следующим
образом (электроны обозначены точками):
Электронную пару можно
обозначить черточкой:
Связь между двумя
атомами образуется тогда, когда они приближаются друг к другу на расстояние,
достаточное для того, чтобы электроны каждого из них оказались в пределах
взаимодействия с ядром другого атома.
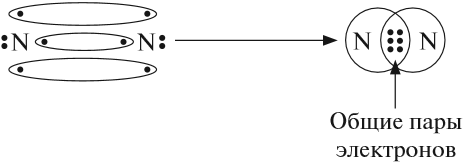
При образовании
молекулы N2. Образуются 3 общие электронные пары. Перекрываются
р-орбитали. (слайд 4)
Связь
называется неполярная.
Предположим, что
связь образуют два неметалла с различными значениями электроотрицательности.
(Учитель берет за
руку ученика, имитируя образование химической связи). Неспаренные электроны
одного атома соединяются с неспаренными электронами другого атома, образуется
общая электронная пара, которая принадлежит каждому из атомов.
— Если сила атомов различная,
их ЭО различная, то связь смещается в сторону более сильного атома, т.е. атома
с большим значением ЭО. Такая связь называется полярной.
Учитель: записываем определение в терадь.
КОВАЛЕНТНАЯ
ПОЛЯРНАЯ СВЯЗЬ (КПС) — образуют
атомы разных неметаллов, отличающихся по значениям электроотрицательности
(Например: HCl, H2O, NH3, HF).
Механизм образования
связи.
Каждый атом неметалла
отдает в общее пользование другому атому свои наружные не спаренные электроны.
Образуются общие электронные пары. Общая электронная пара смещена к более
электроотрицательному элементу.
Рассмотрим механизм образования молекулы
хлороводорода: НCl – кпс.
Электронная схема образования молекулы НCl:
Учитель: Общая электронная пара смещена к хлору,
как более электроотрицательному. Значит это ковалентная связь. Она образована
атомами, электроотрицательности которых несильно отличаются, поэтому это
ковалентная полярная связь.
Структурная формула молекулы НCl:
σ
Н → Cl , σ (s – p)
— одинарная связь σ, смещение электронной плотности в сторону
более электроотрицательного атома хлора (→)
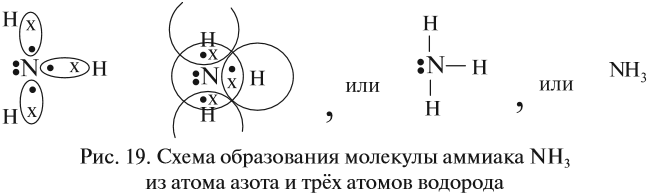
Составление электронных формул молекул фтороводорода и аммиака:
— К доске выходит студент и составляет электронную
формулу.
Студент: При образовании молекулы фтороводорода
перекрывается орбиталь s-электрона водорода и орбиталь р-электрона фтора Н-F.
Связывающая
электронная пара смещена к атому фтора, в результате чего образуется диполь.
Связь называется полярная.
Вывод: Ковалентная связь классифицируется не только по механизму
образования общих электронных пар, соединяющих атомы, но и по способу
перекрывания электронных орбиталей, по числу общих электронных пар, а также по
смещению их к одному из связанных атомов.
В частности по способу перекрывания электронных орбиталей
различают σ- и π-ковалентные связи. Найдите в учебнике, что же такое сигма и
пи-связи.
По числу общих электронных пар, связывающих атомы, т.е.
по кратности, различают ординарные, двойные, тройные связи (делаю пояснения на
доске на примерах молекулы водорода, метана, углекислого газа, этилена, азота,
ацетилена).
По степени смещенности общих электронных пар к одному из
связанных ими атомов ковалентная связь может быть полярной и неполярной. При
этом особую актуальность приобретает такое понятие как электроотрицательность.
4.
Итог урока (комментарий ответов).
—
Ребята мы сегодня изучили ковалентную химическую связь и ее виды. Для
закрепления материала порешаем несколько примеров возле доски.
Составьте
электронные формулы и определите вид связи: HI,
F2,
NF3,
HBr.
HI
– ковалентная полярная;
F2
– ковалентная неполярная;
NF3
– ковалентная полярная;
HBr
– ковалентная полярная;
Выставление
оценок за урок.
5. Домашнее задание: выучить конспект, задание в
тетради.
— Определите вид химической
связи, составьте электронные формулы для ковалентной связи следующих химических
формул: H2S, H2O, I2, CO2
Преподаватель:
Аметова Ульвие Юнусовна
Электронные формулы молекул
Для изображения электронного строения молекул, ионов или радикалов используются электронные формулы (структуры Льюиса, октетные формулы). При написании электронной формулы должно выполняться правило октета, согласно которому атом, участвуя в образовании химической связи (отдавая или принимая электроны), стремится приобрести электронную конфигурацию инертного газа — октет (восемь) валентных электронов. Исключение составляет атом водорода, для которого устойчивой является конфигурация гелия, т.е. 2 валентных электрона.
Примеры электронных формул
- Элементы 3-го и последующих периодов, имеющие на внешнем валентном уровне относительно низкие по энергии 3d-орбитали, могут за счет участия этих орбиталей образовывать более 4-х ковалентных связей. В этом случае правило октета теряет свою силу, например, в соединениях фосфора и серы: (C2H5)3P=O,
CH3-SO3H.
Связывающие электронные пары, соответствующие ковалентным связям между атомами, чаще изображают валентной чертой. Несвязывающие электроны (электроны неподеленных пар, неспаренные электроны в свободных радикалах) обозначают точками, формальные заряды в ионах – знаками «+» или «–»:
Электронные формулы молекул (а также ионов и свободных радикалов) нашли широкое применение в органической химии. Однако они не отражают пространственного строения молекул. Поэтому в тех случаях, когда необходимо иметь представление не только о распределении электронов, но и о пространственном строении органических соединений, используются атомно-орбитальные модели, которые служат основой для построения стереохимических (пространственных) формул молекул.
Типы химической связи.
Ионная связь
Являяcь многие годы вашим подписчиком, всегда
с интересом знакомлюсь с публикациями
разработок уроков, внеклассных мероприятий,
дидактических материалов. Из многих публикаций
удается почерпнуть интересные идеи, на основе
которых разрабатываю собственные уроки.
Имея возможность самостоятельно определять
последовательность изучения материала в курсе
химии, после изучения темы «Периодический закон
и периодическая система химических элементов
Д.И.Менделеева на основе строения атомов» считаю
необходимым изучение материала по теме
«Строение вещества». Рассмотрение темы
«Строение вещества» в 8-м классе позволяет на
более глубоком уровне изучать последующие темы
курса, например «Галогены», «Щелочные металлы» и
др.
Предлагаю вашему вниманию разработку урока
по теме «Ионная связь». Урок построен таким
образом, чтобы учащиеся, повторив ранее
изученный материал, успешно освоили новый.
Надеюсь, что разработка урока будет полезна
коллегам – учителям химии, позволит сделать
уроки интересными, организовать самостоятельную
творческую работу ребят.
Задачи урока. Образовательные:
повторение, коррекция и закрепление знаний по
теме «Строение атомов»; закрепление понятий
«электроотрицательность», «ковалентная
полярная связь» и «ковалентная неполярная
связь»; введение понятий «ионы», «ионная связь»;
изучение нового типа химической связи –
ионной связи, ее природы и условий образования;
обучение навыкам сравнения схем строения
нейтральных атомов и ионов.
Развивающие: развитие навыков составления
электронных схем образования химических связей,
соединений с ионным типом связи и определения
количества электронов в ионах; развитие умений
определения типа связи на основании анализа
состава химического соединения.
Оборудование. Периодическая система
химических элементов, карточки с формулами
веществ (H2O, Br2, CO2, O3, HCl, HNO3,
P4, CS2, H2SO4, S8),
раздаточные материалы, цветные сигнальные
карточки с цифрами: красная – 1, синяя – 2,
фиолетовая – 3.
Тип урока. Комбинированный (80 мин.)
ХОД УРОКА
Повторение ранее изученного
материала
Учитель. Сегодня нам с вами предстоит
покорить одну из важнейших вершин науки
химии – вершину «Химическая связь». Чтобы
начать восхождение, нужно к нему подготовиться,
собрать рюкзаки, в которые сложить все
необходимые знания. Для начала посмотрим, как вы
это делаете самостоятельно.
Собираем рюкзаки. Учащимся предлагается
выполнить самостоятельную работу с последующей
самопроверкой. Самостоятельная работа решает
задачу актуализации знаний, играет роль входной
диагностики (определение готовности учащихся к
дальнейшей работе по теме).
Задание учащиеся получают на карточках. Два
ученика с хорошим уровнем подготовки работают за
отдельным столом, выполняя работу маркерами на
листах формата А4. По окончании работы они
вывешивают их на доску. Два хорошо
подготовленных ученика комментируют
выполненную работу, отвечают на уточняющие
вопросы учителя и одноклассников. Остальные
ученики класса проверяют свою работу
самостоятельно, по ходу комментирования.
Ученики, выполнившие работу и
прокомментировавшие ее, получают оценки.
Самостоятельная работа
Задание 1. По электронной формуле
определите положение элемента в периодической
системе, назовите его.
В а р и а н т I. 1s22s 22p63s23p4
.
В а р и а н т II. 1s22s1.
Задание 2. Исходя из положения элементов
в периодической системе, сравните их
электроотрицательность и поставьте между ними
знак <, >, =.
В а р и а н т I.
1) ЭО (Br) * ЭО (Li);
2) ЭО (Al) * ЭО (Cl);
3) ЭО (S) * ЭО (O).
В а р и а н т II.
1) ЭО (Mg) * ЭО (F);
2) ЭО (C) * ЭО (O);
3) ЭО (I) * ЭО (Cl).
Задание 3. Определите количество
электронов на внешнем уровне в атомах.
В а р и а н т I. Cl, K, P.
В а р и а н т II. Ca, S, F.
Задание 4. Определите, сколько
электронов не хватает каждому атому до
завершения внешнего уровня.
В а р и а н т I. C, S, Cl.
В а р и а н т II. O, P, I.
Задание 5. Закончите предложение.
В а р и а н т I. Ковалентная неполярная связь
образуется между …………………. .
В а р и а н т II. Ковалентная полярная связь
образуется между …………………… .
Ответы к самостоятельной работе
Задание 1.
В а р и а н т I. Электронная формула 1s22s22p63s23p4
соответствует атому серы. Элемент находится в 3-м
периоде в VI группе.В а р и а н т II. Электронная формула 1s22s1
соответствует атому лития. Элемент находится во
2-м периоде в I группе.Задание 2.
В а р и а н т I.
1) ЭО (Br) > ЭО (Li);
2) ЭО (Al) < ЭО (Cl);
3) ЭО (S) < ЭО (O).
В а р и а н т II.
1) ЭО (Mg) < ЭО (F);
2) ЭО (C) < ЭО (O);
3) ЭО (I) < ЭО (Сl).
Задание 3.
В а р и а н т I. Cl – 7, K – 1, P – 5.
В а р и а н т II. Ca – 2, S – 6, F – 7.
Задание 4.
В а р и а н т I. C – 4, S – 2, Cl – 1.
В а р и а н т II. O – 2, P – 3, I – 1.
Задание 5.
В а р и а н т I. Ковалентная неполярная связь
образуется между атомами с одинаковой
электроотрицательностью, например между атомами
одного химического элемента-неметалла.В а р и а н т II. Ковалентная полярная связь
образуется между атомами, у которых
электроотрицательность отличается
незначительно, между разными атомами химических
элементов-неметаллов.
Учитель. Задание выполнено хорошо, однако
некоторые ребята допустили ошибки. Давайте еще
раз повторим основные понятия и проверим умения
составлять электронные схемы образования
ковалентной связи, чтобы наш рюкзак был собран
правильно.
1-я группа. Учащиеся, выполнившие
самостоятельную работу без ошибок (по
результатам самопроверки), выполняют
проверочную работу на оценку.
Ц е л ь. Применение знаний в новой ситуации.
Проверочная работа
В а р и а н т I.
1. Составьте формулы веществ, состоящих из
двух элементов, электронные формулы атомов
которых: а) 1s22s22p3; б) 1s1.
Укажите тип химической связи в этих молекулах и
составьте электронные схемы ее образования.
2. На основании положения элементов в
периодической системе расположите их в порядке
возрастания электроотрицательности их атомов:
а) S, Cl, O, K; б) F, P, Сa, N.
В а р и а н т II.
1. Составьте формулы возможных веществ,
состоящих из двух элементов, электронные формулы
атомов которых: а) 1s22s22p63s23p4;
б) 1s1. Укажите тип химической связи в
этих молекулах и составьте электронные схемы ее
образования.
2. На основании положения элементов в
периодической системе расположите их в порядке
возрастания электроотрицательности их атомов: а)
Cl, I, Li, Al; б) C, N, Si, Ba.
2-я группа. Учащиеся, допустившие ошибки,
составляют рассказ, заполняя пропуски
предложенными словами и фразами. В случае
затруднения пользуются учебником, записями в
тетради.
Ц е л ь. Повторение, коррекция и закрепление
знаний.
Клише рассказа
В периодической системе элементы расположены
по группам и периодам. Общее количество
электронов в атоме равно ……….. . Номер периода
соответствует …… . Номер группы показывает
………. . Завершенный внешний уровень содержит
……….. .
Электроотрицательность – это способность
атомов притягивать к себе электроны от других
атомов. В периодах слева направо
электроотрицательность …..……. , в главных
подгруппах сверху вниз – ………………. .
Ковалентная неполярная связь образуется между
……..……. . Ковалентная полярная связь образуется
между…………… .
С л о в а и ф р а з ы:
1) между атомами одного химического
элемента-неметалла,2) число электронов на внешнем уровне
элементов главных подгрупп,3) увеличивается,
4) порядковому номеру элемента,
5) восемь электронов,
6) уменьшается,
7) количеству энергетических уровней,
между разными атомами химических
элементов-неметаллов.
1-я группа сдает работы на проверку учителю,
оценки будут объявлены на следующем уроке.
2-я группа проверяет свои работы при
прослушивании ответа одного из учеников. При
необходимости даются пояснения.
Ответы на проверочную работу
В а р и а н т I.
1. Электронные формулы соответствуют: а) 1s22s22p3 –
атому азота; б) 1s1 – атому водорода.
Эти элементы образуют следующие соединения –
N2 , H2, NH3. В молекулах N2, H2 –
ковалентная неполярная связь; в молекуле NH3 –
ковалентная полярная связь.Электронные схемы образования.
2. На основании положения элементов в
периодической системе электроотрицательность
возрастает в следующем порядке: а) K, S, Cl, O; б) Ca, P, N,
F.В а р и а н т II.
1. Электронные формулы соответствуют а) 1s22s22p63s23p4 –
атому серы; б) 1s1 – атому водорода.
Эти элементы образуют следующие соединения: S2,
H2, Н2S. В молекулах S2, H2 –
ковалентная неполярная связь; в молекуле Н2S –
ковалентная полярная связь.Электронные схемы образования.
S2 *:
H2:
Н2S:
2. На основании положения элементов в
периодической системе электроотрицательность
возрастает в следующем порядке: а) Li, Al, I, Cl; б) Ba, Si,
C, N.В периодической системе элементы
расположены по группам и периодам. Общее
количество электронов в атоме равно порядковому
номеру элемента. Номер периода соответствует
количеству энергетических уровней. Номер
группы показывает число электронов на внешнем
уровне для элементов главных подгрупп. Завершенный
внешний уровень содержит восемь электронов.Электроотрицательность – это способность
атомов притягивать к себе электроны от других
атомов. В периодах слева направо
электроотрицательность увеличивается, в
главных подгруппах сверху вниз – уменьшается.Ковалентная неполярная связь образуется
между атомами одного химического
элемента-неметалла. Ковалентная полярная
связь образуется между разными атомами
химических элементов-неметаллов.
Учитель. Итак, рюкзаки собраны, начинаем наше
восхождение. Однако в пути нас поджидают
препятствия. И первое препятствие – «водопад»
веществ.
На доске картина с изображением водопада. На
водопаде прикреплены карточки с химическими
формулами: H2O, Br2, CO2, O3, HCl,
HNO3, P4, CS2, H2SO4, S8.
Задание. Чтобы преодолеть водопад,
предлагается распределить вещества по типам
химической связи.
В а р и а н т I. Выписать в тетрадь вещества с
ковалентной полярной связью.
В а р и а н т II. Выписать вещества с
ковалентной неполярной связью.
Проверка осуществляется фронтально.
Ответ. Вещества с ковалентной полярной
связью – H2O, CO2, HCl, HNO3,CS2,
H2SO4.Вещества с ковалентной неполярной связью –
Br2, O3, P4, S8.
Учитель. Замечательно, мы успешно преодолели
водопад, но впереди нас поджидает новое
препятствие. На узкой горной тропе образовался
«завал» из электронных схем.
Задание. Определить, какая из схем
правильно отражает механизм образования
химической связи.
В а р и а н т I. OF2
В а р и а н т II. BCl3
Электронные схемы написаны на обратной стороне
доски. У каждого учащегося три цветные
сигнальные карты с номерами. Учащиеся поднимают
карточки с номером правильного ответа. Если
допущены ошибки, проводится коррекционная
работа.
Учитель. Молодцы, нам удалось пройти по узкой
горной тропе, и мы продолжаем восхождение.
Внимание! Впереди возникла пещера. Любопытные
альпинисты обнаружили в ней интересную
находку – ларчик и загадочное письмо.
Продолжить путешествие мы сможем только
тогда, когда отгадаем, что находится в этом
ларчике. Что ж, давайте остановимся на привал и
прочитаем письмо.
На столе учителя «ларчик», запечатанный
сургучной печатью. Рядом с ним свернутое письмо.
Ученику предлагается прочитать письмо.
Ученик (читает текст письма). Из вещества,
спрятанного в этой коробке, можно получить
металл, который легко режется ножом, мнется как
пластилин и хранится только под слоем керосина.
Из него можно также получить удушливый и
ядовитый газ желто-зеленого цвета, который
используют для обеззараживания воды. Но обычно
мы используем это вещество иначе. Оно в каждом
доме, на каждом столе. В древние времена говорили,
что оно дороже золота, поскольку без золота можно
прожить, а без него нельзя. По русскому обычаю
дорогих гостей встречают этим веществом, тем
самым желают им здоровья, а просыпать его –
значит потерять здоровье, потерпеть неудачу.
Учитель. О каком таинственном веществе идет
речь в письме? Какие вещества из него получают?
Учащиеся угадывают вещество, дают ему
химическое название – поваренная соль, хлорид
натрия. Указывают, что из него можно получить
металлический натрий и газообразный хлор. Из
«ларчика» достается образец минерала,
показывается учащимся.
Учитель. Какое отношение это вещество имеет к
нашему уроку?
Ученик. Поскольку мы изучаем тему «Химическая
связь», то необходимо выяснить, как она
образуется между атомами в хлориде натрия и к
какому типу ее следует отнести.
Изучение нового материала
Учитель. Молодцы. Цель нашего урока –
познакомиться с новым типом химической
связи – ионной, выяснить ее природу и условия
образования. Мы научимся строить электронные
схемы образования соединений с ионным типом
химической связи, определять общее количество
электронов в ионах.
Тема урока и формула поваренной соли
записываются в тетрадь.
Учитель. Рассмотрим на примере хлорида натрия
образование ионной связи. Запишем уравнение,
отражающее взаимодействие атомов натрия и хлора:
Na + Cl = NaCl.
Составьте самостоятельно в тетрадях схемы
строения атомов натрия и хлора. Определите число
спаренных и неспаренных электронов на последнем
уровне в атомах.
Na +11 1s22s22p63s1;
Сl +17 1s22s22p63s23p5.
Атомы натрия и хлора имеют по одному
неспаренному электрону. При сближении этих
атомов до определенного расстояния происходит
перекрывание электронных облаков неспаренных
электронов и образуется общее для двух атомов
электронное облако. Но поскольку
электроотрицательность хлора намного больше,
чем натрия, то общая электронная пара полностью
смещается к атому хлора. В результате перехода
электрона от атома натрия к атому хлора
появляются противоположно заряженные частицы:
атом хлора приобретает отрицательный заряд, атом
натрия – положительный.
(Вводится понятие «ион», «ионная связь»,
определения записываются в тетрадь.)
Частицы, которые образуются в результате
перехода электронов от одного атома к другому,
называются ионами.
Na0 – 1e —> Na1+, Cl0
+ 1e —> Cl1–.
Заряд иона определяется количеством отданных
или принятых электронов. Отрицательно
заряженный ион заключается в квадратные скобки.
Химическая связь, которая возникает между
ионами в результате электростатического
взаимодействия, называется ионной.
Давайте рассмотрим схемы строения ионов
натрия и хлора и определим общее количество
электронов в каждом ионе:
Na1+ +11 , 1s22s22p63s0
(10 электронов);
Cl1– +17
, 1s22s22p63s23p6
(18 электронов).
Проверим наши главные выводы.
• Ионы – это заряженные частицы, в которые
превратились атомы в результате отдачи или
присоединения электронов.• Связь, которая возникает в результате
электростатического взаимодействия между
ионами, называется ионной.• Ионная связь возникает между атомами
металлов и неметаллов,
электороотрицательность которых сильно
отличается (более чем на две единицы). Ионная
связь – это крайний случай ковалентной
полярной связи.
В пути наш багаж знаний пополнился. Продолжим
движение к вершине. Но неожиданно возникает
новая преграда. Впереди густые «заросли» из
химических формул, через которые можно
пробраться, если удалить вещества с ионным типом
химической связи.
На доске написаны формулы:
СCl4, Na2SO4, I2, LiBr, F2,
CaCl2, KI, Na2S, Mg(NO3)2, SO2, Cl2,
BaO, I2, N2, MgS.
Учащимся предлагается выписать в тетрадь
соединения с ионным типом связи.
Проверка фронтальная. Один ученик зачитывает
формулы, которые записал в тетрадь, остальные
ученики – проверяют. Учителем даются
пояснения по веществам, состоящим из трех
химических элементов и имеющим два вида связи.
Ответ. Na2SO4, LiBr, CaCl2, KI, Na2S,
Mg(NO3)2, BaO, MgS.
Учитель. Нам удалось проложить тропинку
сквозь густые заросли, мы очень близки к цели.
Давайте соберем все наши знания и поднимемся на
вершину.
Под руководством учителя закрепляется умение
составлять схемы образования ионной связи,
определять заряды ионов, количество электронов в
ионах на примере соединений: а) KF; б) Na2S; в) BeO.
Далее учащиеся выполняют подобную работу
самостоятельно, выбрав из предложенных формул
две любые: а) LiBr; б) CaCl2; в) MgS; г) Мg3N2*.
Одновременно у доски работают три ученика.
Задание со звездочкой (*) на данном уроке не
объясняется и не проверяется, объяснение будет
дано на заседании химического кружка.
Проверка результатов проводится фронтально.
Закрепление материала
Учитель. Мы проделали трудный, но интересный
путь, вершина «Химическая связь» покорена. Я
поздравляю вас, вы приложили много усилий, чтобы
ее достичь, показали ваши знания, проявили
находчивость, были дружными, помогали друг другу
в трудный момент. А теперь пора в обратный путь.
Учащимся предлагается выполнить проверочную
работу. Ц е л ь: оперативный контроль знаний.
Результаты выполнения будут использованы при
планировании индивидуальной коррекционной
работы с учащимися.
Проверочная работа
1. Определите количество электронов на
внешнем уровне в атомах.
В а р и а н т I. F, B, Ca.
В а р и а н т II. Se, Al, C.
2. Укажите количество электронов, которое
примет атом для завершения своего внешнего
уровня.
В а р и а н т I. S, P, Si.
В а р и а н т II. F, N, O.
3. Укажите тип химической связи в
соединениях.
В а р и а н т I. CH4, K2O, F2.
В а р и а н т II. PCl3, O3, Al2O3.
4. Составьте электронные схемы образования
химической связи, укажите заряды ионов и
определите количество электронов в каждом виде
атомов и ионов.
В а р и а н т I. а) KBr; б) AlCl3.
В а р и а н т II. а) MgI2; б) NaBr.
Заполните таблицу.
Таблица
| Атом | Количество электронов | Ион | Количество электронов |
| … | …………… | … | ………… |
| … | …………… | … | ………… |
| … | …………… | … | ………… |
| … | …………… | … | ………… |
5*. Проанализируйте рисунок и
впишите недостающие формулы.
Ответы к проверочной работе
Задание 1.
В а р и а н т I. F – 7, B – 3, Ca – 2.
В а р и а н т II. Se – 6, Al – 3, C – 4.
Задание 2.
В а р и а н т I. S – 2, P – 3, Si – 4.
В а р и а н т II. F – 1, N – 3, O – 2.
Задание 3.
В а р и а н т I. В соединениях: CH4 –
ковалентная полярная химическая связь, K2O –
ионная связь, F2 – ковалентная
неполярная связь.В а р и а н т II. В соединениях: PCl3 –
ковалентная полярная связь, O3 –
ковалентная неполярная связь, Al2O3 –
ионная связь.Задание 4.
В а р и а н т I.
а) Для KBr:
K0 – 1e —> K1+, Br0 + 1e
—> Br1–.б) Для AlCl3:
Al0 – 3e —> Al3+, Cl0 + 1e
—> Cl1–.
Атом Количество электронов Ион Количество электронов Al0 13 Al3+ 10 Cl 0 17 Cl1– 18 K0 19 K1+ 18 Br0 35 Br1– 36 В а р и а н т II.
а) Для MgF2:
Mg0 – 2e —> Mg2+, F0 + 1e
—> F1–.б) Для NaBr:
Na0 – 1e —> Na1+, Br0 + 1e
—> Br 1–.
Атом Количество электронов Ион Количество электронов Mg0 12 Mg2+ 10 I0 53 I1– 54 Na0 11 Na1+ 10 Br0 35 Br1– 36 Задание 5* (рассматривается
на заседании химического кружка).Ответы могут быть следующие: KCl, KH, Na2O, NaCl
(могут быть и другие соединения металлов с
приведенными в центральной части рисунка
неметаллами, т.е. соединения с ионной связью).
Подведение итогов.
Выставление оценок.
Домашнее задание. Гузей Л.С. Химия.
Вопросы. Задачи. Упражнения. 8–9 классы. § 18.3, упр.
1, 2, 3 – письменно.
* Двухатомные
молекулы S2 образуются при нагревании паров
серы до высокой температуры. – Прим. ред.
Г.Р.ТРОФИМОВА,
учитель химии
лицея № 2
(г. Братск, Иркутская обл.)
Печатать книгу
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 4. Ковалентная связь |
| Напечатано:: | Гость |
| Дата: | Понедельник, 29 Май 2023, 08:35 |
Оглавление
- Ковалентная связь
- Кратность ковалентной связи
- Энергия и длина ковалентной связи
- Полярность ковалентной связи
- Вопросы и задания
Ковалентная связь
Основным типом химических связей в органических соединениях является ковалентная связь. Рассмотрим механизм её образования и основные характеристики.
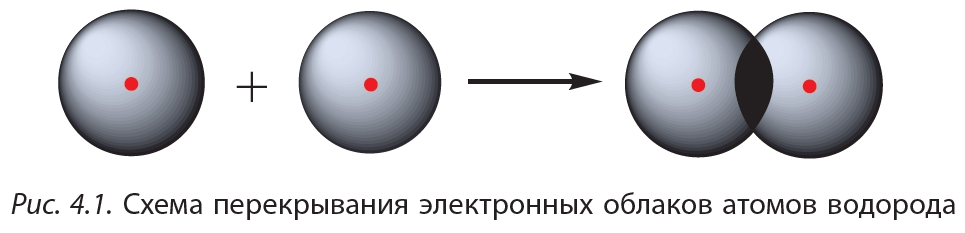
Простейший пример соединения с ковалентной связью — молекула водорода Н2. Атом водорода состоит из положительно заряженного ядра и одного неспаренного электрона, занимающего 1s-орбиталь. При сближении двух атомов водорода происходит перекрывание их электронных облаков:
В результате в пространстве между ядрами происходит увеличение электронной плотности, то есть в этой области концентрируется отрицательный заряд. Этот отрицательный заряд притягивает положительно заряженные ядра, и между атомами формируется химическая связь. Образуется молекула водорода , или Н2. Такая связь называется ковалентной. Чем больше перекрываются электронные облака атомов, тем прочнее будет ковалентная связь.
Схему образования ковалентной связи между атомами водорода можно представить следующим образом:
или:
Из представленной схемы видно, что ковалентная связь осуществляется посредством общей электронной пары. В электронных формулах электронную пару обычно обозначают двумя точками, расположенными между атомами. Если вокруг таких атомов описать окружности, видно, что каждый атом водорода в молекуле имеет завершённую электронную оболочку, как у атома гелия:
В структурных формулах ковалентная связь обозначается чёрточкой:
Используя понятие общей электронной пары, можно дать краткое определение ковалентной связи.
Ковалентная связь — химическая связь, образованная посредством общих электронных пар.
В молекуле водорода общая электронная пара формируется за счёт неспаренных электронов двух атомов водорода. Следовательно, можно заключить, что число ковалентных связей, которое может образовать элемент, равно числу неспаренных электронов в его атоме.
Например, в атоме водорода один неспаренный электрон, поэтому водород может образовать только одну ковалентную связь. Число ковалентных связей, которое образует данный атом в химическом соединении, называется его валентностью. Например, поскольку валентность водорода равна единице, то в структурных формулах от символа H следует рисовать одну чёрточку:
Рассмотрим основные характеристики ковалентной связи.
Кратность ковалентной связи
На внешнем слое атома фтора имеется один неспаренный электрон, поэтому валентность фтора в соединениях равна единице.
От символа F в структурных формулах следует рисовать одну чёрточку:
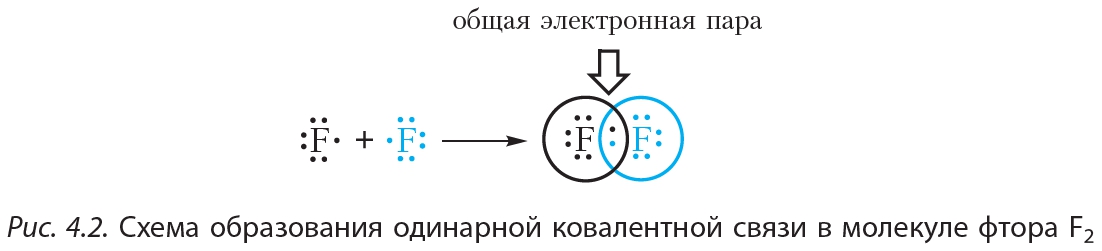
На рисунке 4.2. показана схема образования ковалентной связи в молекуле фтора:
В молекуле фтора атомы связывает одна общая электронная пара. Такая связь называется одинарной.
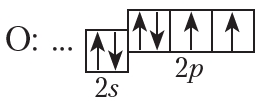
На внешнем слое атома кислорода имеется два неспаренных электрона, поэтому валентность кислорода в соединениях равна двум.
От символа O в структурных формулах следует рисовать две чёрточки:
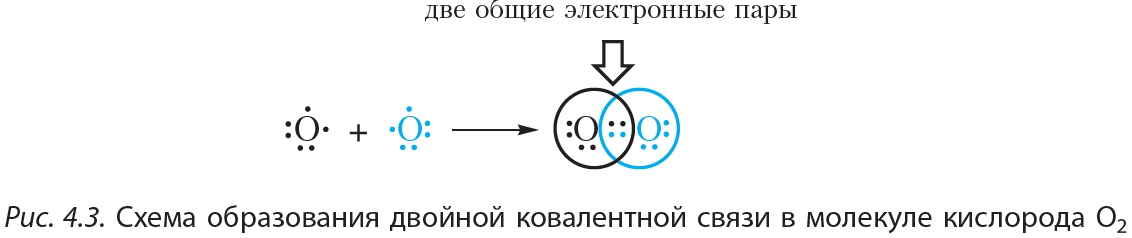
На рисунке 4.3 показана схема образования ковалентной связи в молекуле кислорода:
В молекуле кислорода атомы связывают две электронные пары. Такая связь называется двойной. Двойная связь прочнее одинарной.
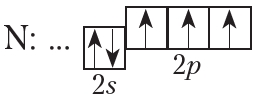
На внешнем слое атома азота имеется три неспаренных электрона, поэтому валентность азота в соединениях равна трём.
От символа N в структурных формулах следует рисовать три чёрточки:
На рисунке 4.4. показана схема образования ковалентной связи в молекуле азота:
В молекуле азота атомы связывают три электронные пары. Такая связь называется тройной. Тройная связь прочнее одинарной и двойной.
Двойные и тройные связи имеют общее название кратные.
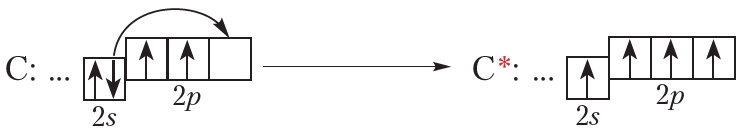
В основном состоянии на внешнем слое атома углерода имеется два неспаренных электрона. Однако, атом углерода легко переходит в возбуждённое состояние, в котором имеется четыре неспаренных электрона:
В связи с этим валентность углерода может быть равна четырём. В большинстве соединений углерод четырёхвалентен. Поэтому в структурных формулах от символа C следует рисовать четыре чёрточки:
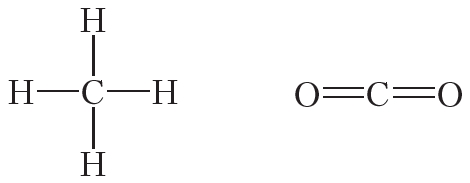
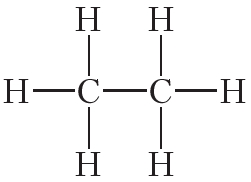
Атомы углерода могут связываться между собой как одинарными, так и кратными связями. Например, в молекуле этана, имеющего состав С2Н6, атомы углерода образуют только одинарные связи:
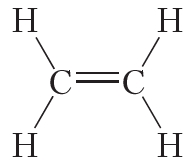
Двойной ковалентной связью атомы углерода соединены между собой в молекуле этилена (С2Н4):
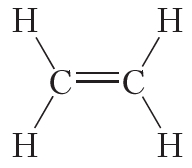
Энергия и длина ковалентной связи
Важнейшими характеристиками ковалентной связи являются её энергия и длина.
Энергия, которую необходимо затратить для разрыва химической связи, называется энергией связи. Энергия связи измеряется в кДж/моль. Чем прочнее связь, тем больше энергии необходимо затратить на её разрыв, следовательно, тем больше энергия связи.
Энергия кратных связей больше, чем одинарных (табл. 4.1). Это вполне понятно, так как для разрушения двух или трёх связей требуется затратить больше энергии, чем для разрыва одной связи.
Атомы, соединённые химической связью, находятся на определённом расстоянии друг от друга. Расстояние между ядрами атомов, образующих связь, называется длиной связи.
Из данных таблицы 1.4 видно, что в ряду этан — этилен — ацетилен с ростом кратности длина связи углерод-углерод уменьшается. То есть при образовании кратных связей атомы сильнее притягиваются друг к другу.
Таблица 4.1. Энергия и длина связи углерод-углерод в некоторых молекулах
|
Название вещества |
Структурная формула |
Энергия связи углерод-углерод, кДж/моль |
Длина связи углерод-углерод, нм |
|
Этан |
 |
370 |
0,154 |
|
Этилен |
 |
612 |
0,134 |
|
Ацетилен |
|
833 |
0,120 |
Полярность ковалентной связи
В молекуле водорода H2 ковалентная связь образуется между атомами одного элемента, поэтому общая электронная пара располагается симметрично (посередине) между ядрами атомов. Такая связь называется ковалентной неполярной.
Пример 1. Ковалентной неполярной связью соединяются между собой атомы неметаллов в простых веществах
Кроме того, ковалентная неполярная связь образуется между атомами углерода в этане , этилене
и ацетилене
.
При образовании ковалентной связи между атомами разных химических элементов общая электронная пара смещается к более электроотрицательному атому. Такая связь называется ковалентной полярной.
Напомним, что электроотрицательность — это способность атома в химическом соединении притягивать к себе электроны других атомов. Самый электроотрицательный элемент — фтор (ЭО — 4,1).
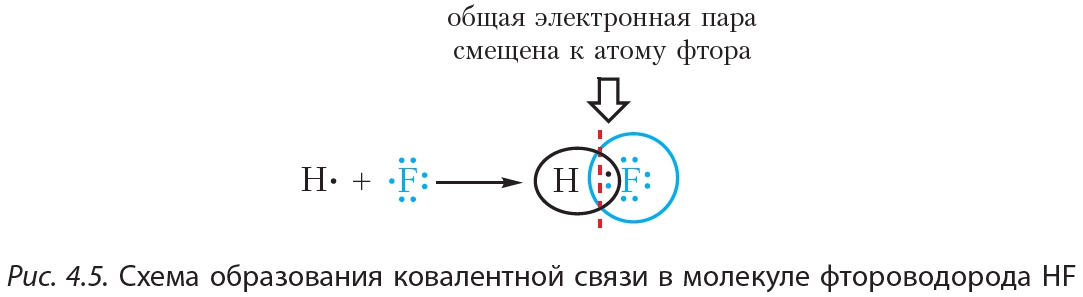
Пример 2. Ковалентная полярная связь в молекуле фтороводорода HF. Молекула образована атомами водорода и фтора. Электроотрицательность фтора выше, чем водорода, поэтому общая электронная пара будет смещена к более электроотрицательному атому фтора (рис. 4.5).
В результате на атоме фтора возникает частичный отрицательный заряд, на атоме водорода — частичный положительный. Частичные, а не полные заряды возникают вследствие того, что общая электронная пара смещается к атому фтора, но полного перехода электрона от одного атома к другому не происходит. Частичный заряд обозначается греческой буквой δ (дельта):
Связь между атомами водорода и фтора является ковалентной полярной.
Ковалентная полярная связь возникает между атомами неметаллов с различной электроотрицательностью, например в молекулах хлороводорода, воды, аммиака:
Чем сильнее различаются между собой электроотрицательности атомов, образующих ковалентную связь, тем больше будут частичные заряды на атомах и тем более полярной будет связь.
Пример 3. Ковалентные полярные связи в молекулах фтороводорода HF и хлороводорода HCl.
Таблица 4.2. Электроотрицательности и частичные заряды на атомах в молекулах HF и HCl
|
Название вещества |
Электроотрицательности элементов |
Частичные заряды на атомах |
|
Фтороводород |
||
|
Хлороводород |
Из таблицы 4.2 видно, что частичные заряды на атомах в молекуле HF значительно больше, чем в молекуле HCl. Следовательно, связь в молекуле HF более полярна, чем в HCl.
Ковалентная связь осуществляется посредством общих электронных пар. В электронных формулах общую электронную пару обозначают двумя точками, расположенными между атомами. В структурных формулах ковалентную связь обозначают чёрточкой.
Ковалентная связь образуется между атомами неметаллов. Между атомами одного и того же неметалла возникает ковалентная неполярная связь. Между атомами разных неметаллов — ковалентная полярная.
Ковалентная связь бывает одинарной, двойной и тройной. Двойная и тройная связи называются кратными.
Чем прочнее связь, тем больше энергия связи. Энергия кратных связей выше энергии одинарных связей. Кратные связи короче одинарных связей.
Вопросы и задания
1. При помощи электронных формул изобразите образование ковалентных связей в молекулах HCl, H2O, NH3, CH4. Укажите валентности элементов в этих веществах.
2. Учитывая, что валентность водорода и хлора равна единице, углерода — четырём, а кислорода — двум, напишите структурные формулы молекул: CCl4, CO2, CH3Cl, C2H6, C2H4, C2H2, C2H5Cl.
3. В какой молекуле, H2O или NH3, ковалентные связи более полярные? Составьте структурные формулы этих молекул и укажите знаки частичных зарядов на атомах.
4. Напишите структурную формулу пероксида водорода H2O2. Укажите полярные и неполярные связи.
5. В какой молекуле, O2 или H2O2, энергия связи кислород-кислород больше?
6. При сильном нагревании может происходить разрыв связей в молекулах. При этом молекулы распадаются на атомы. Какое вещество, Cl2 или N2, будет более устойчиво к нагреванию (термически устойчиво)?
В предыдущих уроках данного курса есть много рассуждений о том, что вещество состоит из молекул, что молекулы состоят из атомов. А не возникал ли у вас вопрос: почему атомы, составляющие молекулу, не разлетаются в разные стороны? Что удерживает атомы в молекуле?
Их удерживает химическая связь.
Химическая связь — совокупность сил, которые удерживают атомы в молекуле или кристалле.
Для того чтобы понять природу химической связи, достаточно вспомнить простой физический опыт. Два шарика, висящие рядом на ниточках, никак не «реагируют» друг на друга. Но если придать одному шарику положительный заряд, а другому — отрицательный, они притянутся друг к другу. Не эта ли сила притягивает атомы друг к другу? Действительно, исследования показали, что химическая связь имеет электрическую природу.
Откуда же возникают заряды в нейтральных атомах?
Содержание
- Ионная связь
- Ковалентная связь
- Химическая связь и агрегатные состояния вещества. Кристаллические решётки
Ионная связь
При описании строения атомов было показано, что все атомы, за исключением атомов благородных газов, стремятся присоединить или отдать электроны. Причина — образование устойчивого восьмиэлектронного внешнего уровня (как у благородных газов). При приёме или отдаче электронов возникают электрические заряды и, как следствие, электростатическое взаимодействие частиц. Так возникает ионная связь.
Ионная связь — это связь между ионами.
Ионы — это устойчивые заряженные частицы, которые образуются в результате приема или отдачи электронов.
Например, в реакции участвует атом активного металла и активного неметалла:
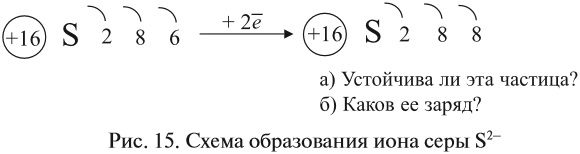
В этом процессе атом металла (натрия) отдаёт электроны (рис. 14).
Таким образом, в этом процессе образовалась устойчивая частица (8 электронов на внешнем уровне), которая имеет заряд, так как у ядра атома натрия заряд по-прежнему +11, а оставшиеся электроны имеют суммарный заряд –10. Поэтому заряд иона натрия +1. Кратко запись этого процесса выглядит так:
Что происходит с атомом серы? Этот атом принимает электроны до завершения внешнего уровня (рис. 15).
Простой подсчёт показывает, что эта частица имеет заряд:
Кратко:
Разноименно заряженные ионы притягиваются, в результате чего возникает ионная связь и «ионная молекула»:
Существуют и другие способы образования ионов (см. урок 6).
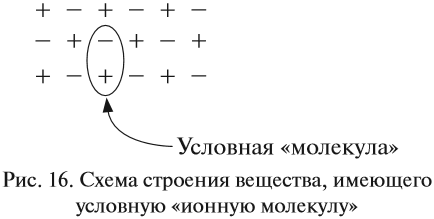
Формально сульфиду натрия приписывают именно такой состав молекулы, хотя вещество, состоящее из ионов, имеет приблизительно такое строение (рис. 16).
Таким образом, можно сказать определённо, что вещества, состоящие из ионов, не содержат отдельных молекул! В этом случае можно говорить лишь об условной «ионной молекуле».
Задание 4.1. Покажите, как происходит переход электронов при возникновении ионной связи между атомами:
- кальцием и хлором;
- алюминием и кислородом.
Помните! Атом металла отдаёт внешние электроны; атом неметалла принимает недостающие электроны.
Вывод. Ионная связь по описанному выше механизму образуется между атомами активных металлов и активных неметаллов.
Ковалентная связь
Исследования, однако, показывают, что полный переход электронов от одного атома к другому происходит далеко не всегда. Очень часто химическая связь образуется не при отдаче-приёме электронов, а в результате образования общих электронных пар*. Такая связь называется ковалентной.
* Эти электронные пары возникают в месте пересечения электронных облаков.
Ковалентная связь образуется в месте перекрывания электронных облаков* обоих атомов.
* Электронное облако — область пространства, где нахождение электрона наиболее вероятно.
Такая связь образуется, например, между атомами неметаллов. Возникает вопрос: каким образом область пересечения электронных облаков может связывать атомы? Рассмотрим динамическую модель этого явления, т. е. процесс возникновения ковалентной связи. Предположим, два атома сблизились на достаточно близкое расстояние.
Вопрос. Какие силы возникли между атомами?
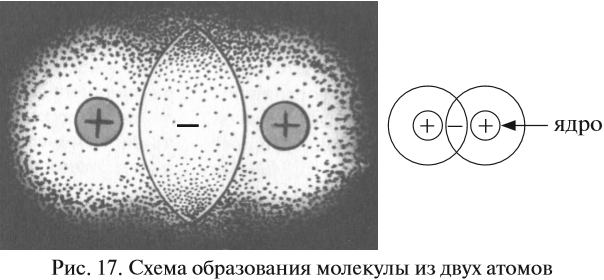
Поскольку вокруг ядер атомов расположены отрицательно заряженные электроны, между атомами возникают силы отталкивания. Но если атомы обладают достаточной энергией, их электронные облака перекрываются (см. рис. 17.).
В этой области пространства возникает избыточный отрицательный заряд. А ядра атомов, как известно, имеют положительный заряд. Таким образом, ядра обоих атомов притягиваются к общему отрицательному заряду, который возник благодаря пересечению электронных облаков. Поэтому:
- во-первых, область перекрывания электронных облаков является, фактически, химической связью;
- во-вторых, чем больше область перекрывания электронных облаков, тем прочнее (при прочих равных условиях) данная связь.
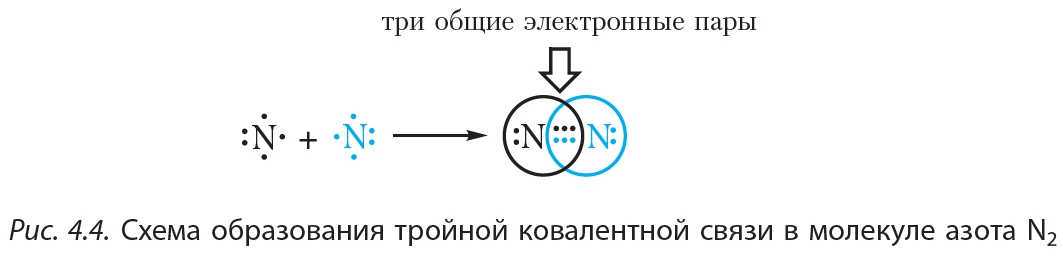
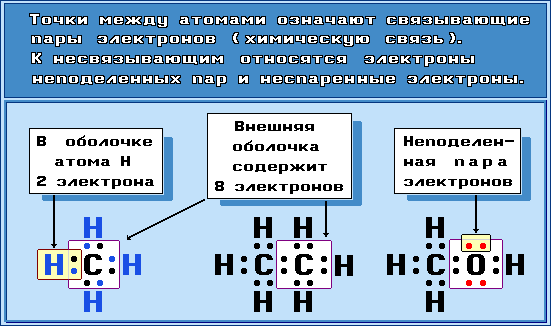
В месте перекрывания электронных облаков образуются общие электронные пары. Рассмотрим, как возникает ковалентная связь в молекуле азота N2. Для этого рассмотрим строение атома азота:
Или: N … 2s2 2р3
Вопрос. Сколько электронов не хватает до завершения внешнего уровня?
Не хватает трёх электронов. Поэтому, обозначив каждый электрон внешнего уровня точкой, получим:
Вопрос. Почему три электрона обозначены одиночными точками?
Дело в том, что мы хотим показать образование общих пар электронов. А пара — это два электрона. Такая пара возникает, в частности, если каждый атом предоставит по одному электрону для образования каждой пары (1 + 1 = 2). Атому азота не хватает трёх электронов до завершения внешнего уровня. Значит, он должен «приготовить» три одиночных электрона для образования будущих пар.
Получена электронная формула молекулы азота, при помощи которой показано, что:
- у каждого атома азота имеется теперь восемь электронов (шесть из них обведены кружочком плюс 2 электрона «собственной», неподелённой пары электронов);
- между атомами возникли 3 общие пары электронов (место пересечения кружков).
Каждая общая пара электронов соответствует одной ковалентной связи. Сколько ковалентных связей возникло? Три. Каждую связь (каждую общую пару электронов) покажем при помощи чёрточки (валентный штрих):
Эта графическая формула показывает, что атом азота в молекуле N2 — трёхвалентен, так как валентность — это способность атома образовывать определённое число ковалентных химических связей.
Может ли возникнуть такая связь между разными атомами? Может. Пусть атом азота взаимодействует с атомами водорода:
Строение атома водорода показывает, что этот атом имеет один электрон. Сколько таких атомов нужно взять, чтобы атом азота «получил» «желаемое» — три электрона? Очевидно, три атома водорода (рис. 19).
Крестиком (х) обозначены электроны атома водорода. Электронная формула молекулы аммиака показывает, что у атома азота стало восемь электронов, а у каждого атома водорода получилось по два электрона (а больше на первом энергетическом уровне и быть не может).
Графическая формула показывает, что атом азота имеет валентность три (три чёрточки, или три валентных штриха), а каждый атом водорода — валентность один (по одной чёрточке).
Значит, атом азота в этих молекулах (N2 и NН3) трёхвалентен. Поскольку пара электронов может образовываться из неспаренных электронов обоих атомов, то валентность атома часто соответствует числу неспаренных электронов. Например, в атоме азота 3 неспаренных электрона, поэтому валентность атома азота (в молекуле азота) равна III.
Казалось бы, атом азота не может иметь бОльшую валентность, так как в образовании химической связи задействованы все неспаренные электроны. Но у атома азота осталась «лишняя» неподелённая пара электронов, которая не участвовала в образовании ковалентных связей.
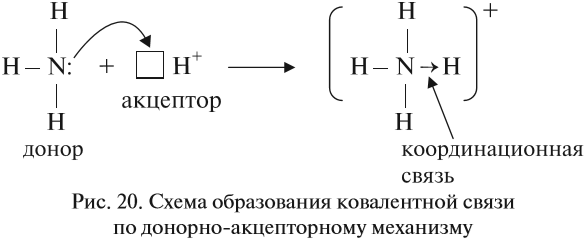
Если ковалентная связь образуется с участием атома, который имеет «собственную» пару электронов (2), то второй атом должен иметь свободную орбиталь (0):
В этом случае атом, имеющий пару электронов (донор), передаёт её на свободную орбиталь второго атома (акцептора). Рассмотрим механизм образования ковалентной связи по донорно-акцепторному механизму:
В полученном катионе аммония валентность атома азота равна IV.
Отметим, что валентность IV для атома азота — максимально возможная. Дело в том, что ковалентные связи образуются за счёт пересечения электронных облаков. А сколько таких электронных облаков в атоме азота? Четыре (одно s— и три р-облака). Поэтому и образуются 4 ковалентные связи. И не больше!
Ковалентная связь может быть полярной и неполярной. Полярность ковалентной связи определяется электроотрицательностью атомов её образующих. Электроотрицательность — способность атома смещать к себе общую пару электронов. Максимальную электроотрицательность (ЭО) имеет фтор 4,1. Далее значение ЭО уменьшается в ряду:
Хотя в состав обеих молекул N2 и NН3 входит один и тот же атом азота, химические связи между атомами отличаются друг от друга. В молекуле азота N2 химические связи образуют одинаковые атомы, поэтому общие пары электронов находятся посередине между атомами. Атомы сохраняют нейтральный характер. Такая химическая связь называется неполярной.
В молекуле аммиака NH3 химическую связь образуют разные атомы. Поэтому один из атомов (в данном случае — атом азота) сильнее притягивает общую пару электронов, так как имеет бОльшую ЭО. Общие пары электронов смещаются в сторону атома азота, и на нём возникает небольшой отрицательный заряд, а на атоме водорода — положительный (рис. 21).
Задание 4.2. Определите, какая химическая связь осуществляется между атомами в веществах:
Дайте пояснения.
Задание 4.3. Составьте электронные и графические формулы для тех веществ из упражнения 4.2, в которых вы определили наличие в них ковалентной связи. Для ионной связи составьте схемы перехода электронов.
Химическая связь и агрегатные состояния вещества. Кристаллические решётки
Тип химической связи влияет на свойства вещества, на его поведение в растворах. Так, чем больше, значительнее притяжение между частицами, тем труднее их оторвать друг от друга, тем труднее перевести твёрдое вещество в газообразное или жидкое состояния. Попробуйте определить, между какими частицами больше силы взаимодействия.
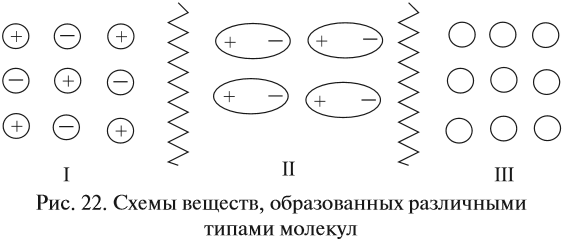
Если силы притяжения частиц значительны (притяжение разноимённо заряженных ионов), то частицы колеблются вблизи положения равновесия, а перемещаться не могут, что обусловливает сохранение формы и объёма. Максимальное взаимодействие между частицами осуществляется в случае I (ионная связь). Такие вещества находятся в твёрдом состоянии. Все вещества, построенные по ионному типу, — твёрдые. Среди веществ с ионной структурой ни жидких, не газообразных веществ нет! Для таких веществ характерно особое внутреннее строение — кристаллическая решётка:
От типа кристаллической решётки, которая формируется в твёрдом состоянии, зависят многие физические свойства вещества. В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решёток: ионные, атомные, молекулярные и металлические.
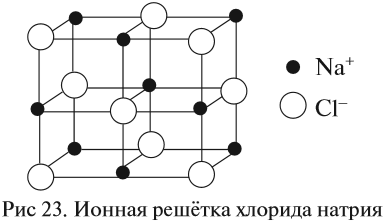
Кристаллические решётки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служить кристалл поваренной соли (хлорида натрия), в котором каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия. Очень часто кристаллические решётки изображают, как показано на рис. 23, где указывается только взаимное расположение частиц, но не их размеры.
Такие вещества обладают твёрдостью, тугоплавкостью, их расплавы проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде, хотя бывают и исключения.
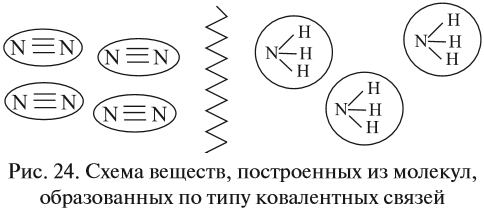
Большинство веществ, построенных при помощи ковалентной связи, состоят из отдельных молекул (рис. 24).
К таким веществам относятся спирты, сахара и большинство органических соединений. Поэтому, если такое вещество станет твёрдым, то эти молекулы образуют молекулярную кристаллическую решётку, т. е. в узлах её находятся молекулы.
Кристаллические решётки, состоящие из молекул (полярных и неполярных), называются молекулярными. Молекулы в таких решётках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решёткой имеют малую твёрдость и низкие температуры плавления, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решёткой невелико: вода, кислоты.
Кристаллические решётки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решётках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами:
Весь кристалл алмаза следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твёрдого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием, а также кварца — чистого оксида кремния. Такие вещества очень прочные и тугоплавкие. Они нерастворимы в воде и прочих растворителях.
Металлы образуют металлическую кристаллическую решётку. Свойства таких веществ рассмотрены в уроке 8 данного Самоучителя.
Подведём итог:
- молекулярное строение имеют вещества, построенные при помощи ковалентной связи, которые, связывая атомы, образуют молекулы;
- немолекулярное строение имеют вещества, построенные при помощи
- ковалентной связи, которые связывают отдельные атомы;
- металлической связи;
- ионной связи.
Задание ЕГЭ. К числу веществ молекулярного строения относятся: 1) древесный уголь; 2) кварц; 3) лёд; 4) известняк. Укажите тип кристаллической решётки в остальных веществах.
Наименьшее взаимодействие между незаряженными частицами (рис. 22, случай III), поэтому между молекулами вещества с неполярной ковалентной связью силы притяжения ничтожны. В этом случае молекулы свободно двигаются во всех направлениях, вещество находится в газообразном состоянии *.
Подробнее о газах рассказано в уроке 30.1 данного Самоучителя. Там же рассматриваются способы решения задач по теме «Газы».
Следовательно, вещества, состоящие из неполярных молекул или молекул с неполярными связями, являются газами или летучими жидкостями. Среди веществ такого типа только йод является твёрдым (при нормальных условиях) из-за высокой массы молекул, но он легко возгоняется, переходя из твёрдого состояния сразу в газообразное состояние.
У полярных молекул (диполей) межмолекулярные взаимодействия многократно сильнее, поэтому частицы могут перемещаться «на один шаг», соблюдая ближний порядок, что обусловливает текучесть жидкости. Впрочем, молекулы с полярными связями могут быть и газообразными, и твёрдыми.
Агрегатное состояние в этом случае (при прочих равных условиях) обычно зависит:
- от молярной массы вещества (чем она больше, тем выше температура плавления или кипения);
- от степени полярности связей (чем она больше, тем выше температура плавления или кипения);
- от наличия водородных связей.
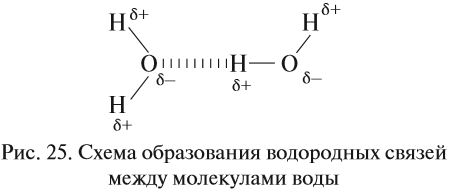
Водородные связи возникают за счёт сильно полярных связей, содержащих атом водорода: N–H, O–H, F–H.
В таких случаях на атомах возникают довольно значительные заряды (δ+) и (δ–) (но всё же меньше единицы!), и атомы (а, значит, и молекулы в целом) притягиваются друг к другу. Атом водорода имеет очень маленький радиус и может частично «внедряться» в электронное облако соединённого атома:
Поэтому все молекулы воды оказываются связанными бесчисленными водородными связями. В результате на разрыв всех этих связей требуется затратить очень много энергии (например, при испарении воды). Поэтому вода имеет аномально высокую температуру кипения:
Если рассуждать логически, опираясь на положение кислорода в периодической системе, экстраполировать параметры в системе Н2О — H2S — H2Se — H2Тe, то у воды как самого лёгкого водородного соединения шестой группы должна быть температура кипения около –80 °C! А на самом деле? А на самом деле она намного выше: +100 °C.
Выводы. Таким образом, агрегатное состояние веществ (температуры кипения и плавления) зависит:
- от типа химической связи: чем выше полярность связи, тем при прочих равных условиях выше температура плавления;
- от молекулярной массы вещества: чем выше молекулярная масса, тем при прочих равных условиях выше температура плавления;
- от наличия водородных связей, которые, фактически, увеличивают молекулярную массу.












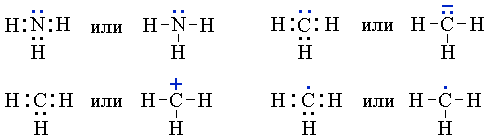
 между разными атомами химических
между разными атомами химических