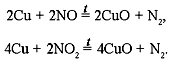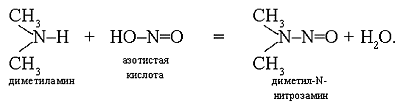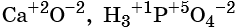1. Положение азота в периодической системе химических элементов
2. Строение атома азота
3. Физические свойства и нахождение в природе
4. Строение молекулы
5. Соединения азота
6. Способы получения
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и кремнием
7.1.3. Взаимодействие с водородом и фосфором
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
Аммиак
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с серной кислотой
3.2. Взаимодействие с азотной кислотой
3.3. Взаимодействие с солями
Соли аммония
Способы получения солей аммония
Химические свойства солей аммония
Оксиды азота
1. Оксид азота (I)
2. Оксид азота (II)
3. Оксид азота (III)
4. Оксид азота (IV)
5. Оксид азота (V)
Азотная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация азотной кислоты
2.3. Взаимодействие с основными и амфотерными оксидами и гидроксидами
2.4. Вытеснение более слабых кислот из солей
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
2.7. Окисление сложных веществ
2.8. Взаимодействие с белками
Азотистая кислота
Соли азотной кислоты — нитраты
Соли азотистой кислоты — нитриты
Азот
Положение в периодической системе химических элементов
Азот расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение азота
Электронная конфигурация азота в основном состоянии:
Атом азота содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV. Также характерная валентность азота в соединениях — III.
Степени окисления атома азота – от -3 до +5. Характерные степени окисления азота -3, 0, +1, +2, +3, +4, +5.
Физические свойства и нахождение в природе
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Строение молекулы
Связь между атомами в молекуле азота – тройная, т.к. у каждого атома в молекуле по 3 неспаренных электрона. Одна σ-связь (сигма-связь) и две — π-связи.
Структурная формула молекулы азота:
Структурно-графическая формула молекулы азота: N≡N.
Схема перекрывания электронных облаков при образовании молекулы азота:
Соединения азота
Типичные соединения азота:
| Степень окисления | Типичные соединения |
| +5 | оксид азота (V) N2O5
азотная кислота HNO3 нитраты MeNO3 |
| +4 | оксид азота (IV) NO2 |
| +3 | оксид азота (III)
азотистая кислота нитриты MeNO2 |
| +2 | оксид азота (II) NO |
| +1 | оксид азота (I) |
| -3 | аммиак NH3
нитриды металлов MeN бинарные соединения азота с неметаллами |
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
NaNO2 + NH4Cl → NH4NO2 + NaCl
NH4NO2 → N2 + 2H2O
Суммарное уравнение процесса:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
Видеоопыт взаимодействия нитрита натрия с хлоридом аммония можно посмотреть здесь.
Азот также образуется при горении аммиака:
4NH3 + 3O2 → 2N2 + 6H2O
2. Наиболее чистый азот получают разложением азидов щелочных металлов.
Например, разложением азида натрия:
2NaN3 → 2Na + 3N2
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре ~700 °C:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (3000оС-5000оС или действие электрического разряда) образуется атомарный азот, который реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с серой, фосфором, мышьяком, углеродом.
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например, литий реагирует с азотом с образованием нитрида лития:
N2 + 6Li → 2Li3N
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 + 3LiH → Li3N + NH3
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск
ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка.
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами. Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например, хлорид аммония реагирует с нитратом серебра:
NH4Cl + AgNO3 → AgCl + NH4NO3
3. Средние соли аммония можно получить из кислых солей аммония. При добавлении аммиака кислая соль переходит в среднюю.
Например, гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
NH4НCO3 + NH3 → (NH4)2CO3
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты, почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4+ + Cl–
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями, если в продуктах образуется газ, осадок или образуется слабый электролит.
Например, карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
Соли аммония реагируют с щелочами с образованием аммиака.
Например, хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону, т.к. гидроксид аммония — слабое основание:
NH4Cl + Н2O ↔ NH3 ∙ H2O + HCl
NH4+ + HOH ↔ NH3 ∙ H2O + H+
4. При нагревании соли аммония разлагаются. При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3
NH4HS → NH3 + H2S
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
NH4NO2 → N2 + 2H2O
190 – 245° C:
NH4NO3 → N2O + 2H2O
При температуре 250 – 300°C:
2NH4NO3 → 2NO + 4H2O
При температуре выше 300°C:
2NH4NO3 → 2N2 + O2 + 4H2O
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II) | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (I)
Оксид азота (I) – это несолеобразующий оксид. Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз.
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получить оксид азота (I) в лаборатории можно разложением нитрата аммония:
NH4NO3 → N2O + 2H2O
Химические свойства оксида азота (I):
1. При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя. Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
N2O + H2 → N2 + H2O
N2O + Mg → N2 + MgO
N2O + 2Cu → N2 + Cu2O
3N2O + 2NH3 → 4N2 + 3H2O
N2O + H2O + SO2 → N2 + H2SO4
Еще пример: оксид азота (I) окисляет углерод и фосфор при нагревании:
N2O + C → N2 + CO
5N2O + 2Р → 5N2 + Р2O5
2. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
Например, N2O окисляется раствором перманганата в серной кислоте:
5N2O + 3H2SO4 + 2KMnO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O
Оксид азота (II)
Оксид азота (II) – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения.
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например, при действии 30 %-ной азотной кислоты на медь образуется NO:
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
3FeCl2 + NaNO3 + 4HCl → 3FeCl3 + NaCl + NO + 2H2O
2HNO3 + 6HI → 2NO + I2 + 4H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
N2 + O2 → 2NO
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака:
4NH3 + 5O2 → 4NO + 6H2O
Химические свойства.
1. Оксид азота (II) легко окисляется под действием окислителей.
Например, горит в атмосфере кислорода:
2NO + O2 → 2NO2
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
NO + O3 → NO2 + O2
2. В присутствии более сильных восстановителей проявляет свойства окислителя. В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например, оксид азота (II) окисляет водород и сернистый газ:
2NO + 2H2 → N2 + 2H2O
2NO + 2SO2 → 2SO3 + N2
Оксид азота (III)
Оксид азота (III), азотистый ангидрид – кислотный оксид. За счет азота со степенью окисления +3 проявляет восстановительные и окислительные свойства. Устойчив только при низких температурах, при более высоких температурах разлагается.
Способы получения: можно получить при низкой температуре из оксидов азота:
NO2 + NO ↔ N2O3
Химические свойства:
1. Оксид азота (III) взаимодействует с водой с образованием азотистой кислоты:
N2O3 + H2O ↔ 2HNO2
2. Оксид азота (III) взаимодействует с основаниями и основными оксидами:
Например, оксид азота (III) реагирует с гидроксидом и оксидом натрия с образованием нитрита натрия и воды:
N2O3 + 2NaOH → 2NaNO2 + H2O
N2O3 + Na2O → 2NaNO2
Оксид азота (IV)
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения.
1. Оксид азота (IV) образуется при окислении оксида азота (I) и оксида азота (II) кислородом или озоном:
2NO + O2 → 2NO2
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например, при действии концентрированной азотной кислоты на медь:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например, при разложении нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2
Химические свойства.
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
2NO2 + H2O → HNO3 + HNO2
Если растворение NO2 в воде проводить в избытке кислорода, то образуется только азотная кислота:
4NO2 + 2H2O + O2 → 4HNO3
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
3NO2 + H2O → 2HNO3 + NO
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
4NO2 + 2Ca(OH)2 → Ca(NO2)2 + Ca(NO3)2 + 2H2O
В присутствии кислорода образуются только нитраты:
4NO2 + 4NaOH + O2 → 4NaNO3 + 2H2O
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор, уголь, сера, оксид серы (IV) окисляется до оксида серы (VI):
2NO2 + 2S → N2 + 2SO2
2NO2 + 2C → N2 + 2CO2
10NO2 + 8P → 5N2 + 4P2O5
NO2 + SO2 → SO3 + NO
4. Оксид азота (IV) димеризуется:
2NO2 ⇄ N2O4
Оксид азота (V)
N2O5 – оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V).
1. Получить оксид азота (V) можно окислением диоксида азота:
2NO2 + O3 → N2O5 + O2
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V):
2HNO3 + P2O5 → 2HPO3 + N2O5
Химические свойства оксида азота (V).
1. При растворении в воде оксид азота (V) образует азотную кислоту:
N2O5 + H2O → 2HNO3
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например, оксид азота (V) реагирует с гидроксидом натрия:
N2O5 + 2NaOH → 2NaNO3 + H2O
Еще пример: оксид азота (V) реагирует с оксидом кальция:
N2O5 + CaO → Ca(NO3)2
3. За счет азота со степенью окисления +5 оксид азота (V) – сильный окислитель.
Например, он окисляет серу:
2N2O5 + S → SO2 + 4NO2
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
2N2O5 → 4NO2 + O2
Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 + H2SO4(конц) → KHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется стадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциирует в водном растворе.
HNO3 → H+ + NO3–
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, азотная кислота взаимодействует с оксидом меди (II):
CuO + 2HNO3 → Cu(NO3)2 + H2O
Еще пример: азотная кислота реагирует с гидроксидом натрия:
HNO3 + NaOH → NaNO3 + H2O
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например, азотная кислота взаимодействует с карбонатом натрия:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
4. Азотная кислота частично разлагается при кипении или под действием света:
4HNO3 → 4NO2 + O2 + 2H2O
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
8HNO3 (разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
12HNO3(разб) + 10Na → 10NaNO3 + N2 + 6H2O
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
Таблица. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3 + S → H2SO4 + 6NO2 + 2H2O
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
5HNO3 + P → H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
4HNO3 + C → CO2 + 4NO2 + 2H2O
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O
7. Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например, азотная кислота окисляет оксид серы (IV):
2HNO3 + SO2 → H2SO4 + 2NO2
Еще пример: азотная кислота окисляет йодоводород:
6HNO3 + HI → HIO3 + 6NO2 + 3H2O
Азотная кислота окисляет углерод до углекислого газа, т.к. угольная кислота неустойчива.
3С + 4HNO3 → 3СО2 + 4NO + 2H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например, сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
2HNO3 + H2S → S + 2NO2 + 2H2O
При нагревании до серной кислоты:
2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция»).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотистая кислота
Азотистая кислота HNO2 — слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты.
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например, соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 + HCl → HNO2 + AgCl
Химические свойства.
1. Азотистая кислота HNO2 существует только в разбавленных растворах, при нагревании она разлагается:
3HNO2 → HNO3 + 2NO + H2O
без нагревания азотистая кислота также разлагается:
2HNO2 → NO2 + NO + H2O
2. Азотистая кислота взаимодействует с сильными основаниями.
Например, с гидроксидом натрия:
HNO2 + NaOH → NaNO2 + H2O
3. За счет азота в степени окисления +3 азотистая кислота проявляет слабые окислительные свойства. Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например, HNO2 окисляет иодоводород:
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
2НNO2 + 2KI + 2H2SO4 → K2SO4 + I2 + 2NO + 2H2O
Азотистая кислота окисляет соединения железа (II):
2HNO2 + 3H2SO4 + 6FeSO4 → 3Fe2(SO4)3 + N2 + 4H2O
4. За счет азота в степени окисления +3 азотистая кислота проявляет сильные восстановительные свойства. Под действием окислителей азотистая кислота переходит в азотную.
Например, хлор окисляет азотистую кислоту до азотной кислоты:
HNO2 + Cl2 + H2O → HNO3 + 2HCl
Кислород и пероксид водорода также окисляют азотистую кислоту:
2HNO2 + O2 → 2HNO3
HNO2 + H2O2 → HNO3 + H2O
Соединения марганца (VII) окисляют HNO2:
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O
Соли азотной кислоты — нитраты
Нитраты металлов — это твердые кристаллические вещества. Большинство очень хорошо растворимы в воде.
1. Нитраты термически неустойчивы, причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
- Нитраты щелочных и щелочноземельных металлов (до Mg в электрохимическом ряду) разлагаются до нитрита и кислорода.
Например, разложение нитрата натрия:
2KNO3 → 2KNO2 + O2
Исключение – литий.
Видеоопыт разложения нитрата калия можно посмотреть здесь.
- Нитраты тяжелых металлов (от Mg до Cu, включая магний и медь) и литий разлагаются до оксида металла, оксида азота (IV) и кислорода:
Например, разложение нитрата меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Нитраты малоактивных металлов (правее Cu) – разлагаются до металла, оксида азота (IV) и кислорода.
Например, нитрат серебра:
2AgNO3 → 2Ag + 2NO2 + O2
Исключения:
Нитрит железа (II) разлагается до оксида железа (III):
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат марганца (II) разлагается до оксида марганца (IV):
Mn(NO3)2 → MnO2 + 2NO2
2. Водные растворы не обладают окислительно-восстановительными свойствами, расплавы – сильные окислители.
Например, смесь 75% KNO3, 15% C и 10% S называют «черным порохом»:
2KNO3 + 3C + S → N2 + 3CO2 + K2S
Соли азотистой кислоты — нитриты
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна +3, то они проявляют как окислительные свойства, так и восстановительные.
Кислород, галогены и пероксид водорода окисляют нитриты до нитратов:
2KNO2 + O2 → 2KNO3
KNO2 + H2O2 → KNO3 + H2O
KNO2 + H2O + Br2 → KNO3 + 2HBr
Лабораторные окислители — перманганаты, дихроматы — также окисляют нитриты до нитратов:
5KNO2 + 3H2SO4 + 2KMnO4 → 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
3KNO2 + 4H2SO4 + K2Cr2O7 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
В кислой среде нитриты выступают в качестве окислителей.
При окислении йодидов или соединений железа (II) нитриты восстанавливаются до оксида азота (II):
2KNO2 + 2H2SO4 + 2KI → 2NO + I2 + 2K2SO4 + 2H2O
2KNO2 + 2FeSO4 + 2H2SO4 → Fe2(SO4)3 + 2NO + K2SO4 + 2H2O
При взаимодействии с очень сильными восстановителями (алюминий или цинк в щелочной среде) нитриты восстанавливаются максимально – до аммиака:
NaNO2 + 2Al + NaOH + 6H2O → 2Na[Al(OH)4] + NH3
Смесь нитратов и нитритов также проявляет окислительные свойства. Например, смесь нитрата и нитрита калия окисляет оксид хрома (III) до хромата калия:
3KNO2 + Cr2O3 + KNO3 → 2K2CrO4 + 4NO
Экологическая химия азота
Оксиды и гидроксиды
азота
ТАЙНА СТЕПЕНЕЙ ОКИСЛЕНИЯ
Азот образует ряд оксидов, формально
отвечающих всем возможным степеням окисления от
+1 до +5: N2O, NО, N2O3, NO2, N2O5,
однако всего два из них — оксид азота(II) и оксид
азота(IV) — не только устойчивы при обычных
условиях, но и активно задействованы в природном
и промышленном круговоротах азота. Поэтому мы
займемся изучением именно их свойств (в
сравнении). Начнем, как обычно, со строения
молекул.
Cтроение молекул оксидов азота
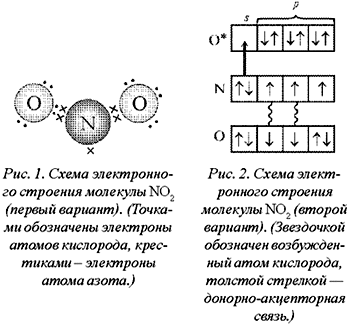
достаточно просто: у кислорода два неспаренных
электрона, у азота три – образуется двойная
связь и один неспаренный электрон в остатке…
Непросто ответить на вопрос, почему такая
«нестандартная» молекула устойчива. Кстати,
стоит заметить, что устойчивые свободные
радикалы – молекулы с неспаренными электронами
– в природе достаточно редки. Можно
предположить, что молекулы NO будут спариваться и
образовывать удвоенную, или димерную, молекулу
ONNO. Таким образом удается решить проблему
неспаренного электрона.
Молекула NO2. Казалось бы, чего проще –
к молекуле NО по неспаренному электрону
присоединился атом кислорода. (На самом деле
присоединяется не атом, а молекула, и не к NО, а к
димеру ОNNO. Поэтому-то и уменьшается скорость
присоединения с повышением температуры – димер
разваливается на половинки.) И теперь уже у
кислорода появился неспаренный электрон –
молекула оксида азота(IV) тоже свободный радикал.
Однако известно, что при соединении двух молекул
NО2 и образовании молекулы N2O4
связь осуществляется через атомы азота, значит,
именно у азота и должен бы быть этот самый
неспаренный электрон. Как это можно осуществить?
Ответ нетрадиционен, но вполне в «характере»
азота – донорно-акцепторная связь. Используя
логику, рассмотрим электроны, которые есть у
атома азота в молекуле NО. Это неспаренный
электрон, свободная пара электронов и еще два
электрона на связи с кислородом – всего пять. А у
атома кислорода, «выходящего на связь», шесть
электронов на четырех орбиталях. Если
расположить их по два, то одна орбиталь останется
свободной. Вот именно ее и занимает пара
электронов атома азота, а неспаренный электрон в
этой связи оказывается совершенно ни при чем
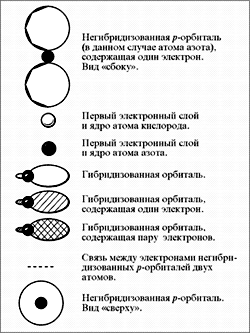
(рис. 1, 2).
Стоит упомянуть еще один момент – раз пара
электронов, находящаяся на s-орбитали,
«пошла на связь», она была просто обязана
подвергнуться гибридизации – очень сложно
предложить второму атому в общее пользование
пару электронов, равномерно распределенную по
поверхности первого атома. Возникает вопрос:
какой тип гибридизации использует атом? Ответ:
три электронные орбитали азота находятся в
состоянии sp2-гибридизации. Молекула NO2
угловая, угол 134° (угол больше 120° потому, что один
электрон отталкивает от себя электроны связи
слабее, чем пара электронов) (рис. 3–5).
Физические свойства оксидов азота
|
|
Рис. 3.
|
Оксид азота(II) NO. Кристаллическая
решетка молекулярная; молекула легкая,
слабополярная (электроотрицательность
кислорода выше, чем у азота, но не намного). Можно
предположить, что температуры плавления и
кипения будут низкими, но выше, чем у азота, т. к.
какая-никакая полярность молекулы дает
возможность подключать электростатические силы
притяжения к просто межмолекулярным силам.
Образование димера тоже способствует повышению
температуры кипения, утяжеляя молекулу. Строение
молекулы позволяет предположить и невысокую
растворимость в воде – растворителе заметно
более полярном, чем NO. Отдельно стоит
подчеркнуть, что оксид азота(II) не имеет ни цвета,
ни запаха.
|
|
Рис. 4. Молекула NO2 — вид «сверху» |
Оксид азота(IV) NO2.
Кристаллическая решетка тоже молекулярная,
однако поскольку сама молекула тяжелее NO и
склонность к димеризации у нее заметно выше, то
плавиться и кипеть это вещество должно при
заметно более высоких температурах. Температура
кипения составляет 21 °С, поэтому при обычных
условиях – 20 °С и 760 мм рт. ст. – оксид азота(IV)
жидкий.
Теперь займемся растворимостью. Вспомним, что
под словом «растворимость» могут
подразумеваться и химические реакции с водой;
главное, чтобы растворитель поглотил
растворяемое. При реакции оксидов с водой, как
известно, получаются гидроксиды – формально это
просто гидратированные оксиды, но реальность
зачастую преподносит массу интересного и совсем
неформального. Вот и этот оксид азота в воде
растворяется, одновременно с ней реагируя, и
получается при этом сразу две кислоты!
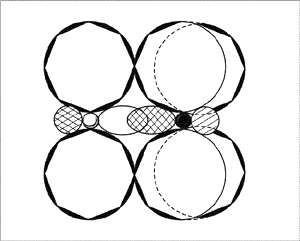 |
Рис. 5.
|
Отметим, что оксид азота(IV) имеет и
характерный резкий запах, и рыжевато-бурый цвет,
оттенки которого отличаются друг от друга в
зависимости от концентрации. Именно за этот цвет
выбросы оксидов азота в атмосферу называют
«лисьими хвостами».
Вы спросите: а где же тайна? Первая часть тайны
степеней окисления перед вами: почему у элемента
пятой (нечетной) группы устойчивы оксиды с
четными степенями окисления? (При этом еще и
свободные радикалы!) В наиболее общем смысле
ответ очевиден – раз устойчивы, значит, им так
выгодно. Энергетически. А почему? Видимо, дело в
специфике строения атомов азота и кислорода – у
них слишком много электронов и слишком мало
орбиталей. Именно «орбитальные возможности»
диктуют свои правила, устанавливают такие
«энергетические выгоды». Тогда цифры «два» и
«четыре» становятся понятными: двух электронов
не хватает кислороду до восьми и у обоих атомов
только по четыре орбитали.
А еще можно сказать, что NO просто… ждет молекулу
кислорода, чтобы превратиться в NО2.
Используя метафору, отметим, что «смысл жизни»
многих атомов – стремление найти себе «партнера
по жизни» – атом или атомы другого элемента. Хотя
есть, конечно, и «убежденные холостяки» типа
золота.
Химические свойства оксидов азота
1. Реакции с металлами. Поскольку атом
азота в положительных степенях окисления
является окислителем, причем чем выше степень
окисления, тем сильнее способность отбирать
электроны у других атомов, то с металлами – по
сути своей восстановителями – оксиды азота
будут реагировать. Продукты при этом могут
получаться совсем разные, в зависимости от
условий реакции и самого металла. Например,
раскаленной меди все оксиды азота отдают
кислород, а сами превращаются в простое вещество
азот:
По количеству образовавшихся оксида меди и
азота можно установить, какой именно из оксидов
азота реагировал с медью.
2. Реакции с неметаллами. В первую
очередь рассмотрим реакции с кислородом. Здесь
между оксидами наблюдается различие, и весьма
существенное.
Оксид NO реагирует с кислородом с
образованием оксида азота(IV). Реакция обратимая.
Причем с повышением температуры скорость этой
реакции уменьшается:
2NO + O2 = 2NO2.
Оксид NO2 с кислородом вообще не
реагирует.
Озон переводит оба оксида в оксид азота(V).
Оксид азота(II) NO присоединяет озон
полностью:
2NO + O3 = N2O5.
Оксид азота(IV) NO2 в реакции с озоном
выделяет еще и кислород:
2NO2 + O3 = N2O5 + O2.
3. Реакции с водой. Оксид NO с водой не
реагирует. Оксид NO2 с водой образует две
кислоты – азотную (степень окисления азота +5) и
азотистую (степень окисления азота +3). В
присутствии кислорода оксид NO2 целиком
переходит в азотную кислоту:
2NO2 + Н2O = НNО3 + НNO2,
4NO2 + O2 + 2Н2О = 4НNО3.
4. Реакции c кислотами. Ни один из
оксидов – NO или NO2 – не реагирует с
кислотами.
5. Реакции со щелочами. Оба оксида азота
реагируют со щелочами.
Оксид NO образует с щелочью соль азотистой
кислоты, оксид азота(I) и азот:
10NO + 6NaOH = 6NaNO2 + N2O + N2 + 3H2O.
Оксид NO2 образует с щелочью соли двух
кислот – азотной и азотистой:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O.
Вернемся к нашей тайне степеней окисления. При
переходе кислородных соединений азота из
состояния «газ», где свободно можно двигаться, в
состояние «водный раствор», где больше толкотни,
где процветает коллективизм, где существуют и
активно действуют полярные молекулы воды, никто
уже не позволит молекуле, атому или иону быть в
одиночестве, происходит «смена ориентации».
Устойчивыми становятся как раз нечетные степени
окисления, как и положено элементу из нечетной
группы. (Устойчивыми, правда, относительно.
Азотистая кислота, например, может существовать
только в растворе, иначе она разлагается. Но
кислот, формально соответствующих оксидам
азота(II) и (IV), вообще не существует. Все познается
в сравнении.)
Интересно, что со щелочами реагирует не только
явно кислотный оксид NO2, но и NО – по
свойствам и степени окисления некислотный, при
этом получаются соединения других степеней
окисления – нечетных! Тайна? Вполне!
Строение молекулы гидроксида азота(V) –
азотной кислоты
Из гидроксидов азота мы рассмотрим один, но
наиболее многотоннажный – азотную кислоту.
Молекула азотной кислоты полярна (в первую
очередь из-за разной электроотрицательности
кислорода и водорода, потому что азот как бы
скрыт внутри молекулы) и асимметрична. Все три
имеющихся в ней угла между связями азота с
кислородом разные. Формальная степень окисления
азота высшая, т. е. +5. Но при этом только четыре
связи у атома азота с другими атомами –
валентность азота равна четырем. Еще одна тайна.
Понятно, как может получиться так, что
валентность атома численно больше его
степени окисления. Для этого достаточно
образовать в молекуле связь между одинаковыми
атомами. Например, в пероксиде водорода у
кислорода валентность два, а степень окисления
только –1. Общую электронную пару связи с
водородом кислороду удалось подтянуть к себе
поближе, а пара связи двух атомов кислорода так и
находится строго посередине. Но как сделать так,
чтобы валентность атома была меньше
степени окисления?
Давайте подумаем: а как вообще устроена молекула
азотной кислоты? Строение молекулы легче понять,
если рассмотреть процесс ее получения. Азотная
кислота получается при реакции оксида азота(IV) с
водой (в присутствии кислорода): две молекулы NO2
одновременно «атакуют» молекулу воды своими
неспаренными электронами, в результате связь
водорода с кислородом разрывается не как обычно
(пара электронов у кислорода и «голый протон»), а
«по-честному» – одной молекуле NO2
достается водород со своим электроном, другой –
радикал ОН (рис. 6). Образуются две кислоты: обе
кислоты сильные, обе быстро отдают свой протон
ближайшим молекулам воды и остаются в итоге в
виде ионов и
. Ион
нестоек, две молекулы НNО2
разлагаются на воду, NО2 и NО. Оксид NO
реагирует с кислородом, превращаясь в NО2, и
так до тех пор, пока не получится одна только
азотная кислота.
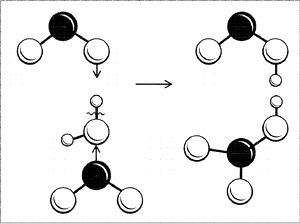 |
Рис. 6.
|
Формально выходит, что с одним атомом
кислорода атом азота связан двойной связью, а с
другим – обычной одинарной связью (этот атом
кислорода связан еще и с атомом водорода). С
третьим атомом кислорода азот в HNO3 связан
донорно-акцепторной связью, причем в качестве
донора выступает атом азота. Гибридизация атома
азота при этом должна быть sр2 из-за
наличия двойной связи, что определяет структуру
– плоский треугольник. Реально получается, что
действительно фрагмент из атома азота и трех
атомов кислорода – плоский треугольник, только в
молекуле азотной кислоты этот треугольник
неправильный – все три угла ОNО разные,
следовательно, и разные стороны треугольника.
Когда же молекула диссоциирует, треугольник
становится правильным, равносторонним. Значит, и
атомы кислорода в нем становятся равноценными!
Одинаковыми становятся и все связи (двойная
связь короче одинарной). Каким образом?
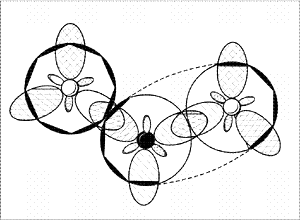
Давайте рассуждать. sр2-Гибридизация
атома азота принуждает к такому же типу
гибридизации и атомы кислорода. Получается
плоская структура, поперек которой расположены
не участвующие в гибридизации р-орбитали,
имеющиеся у всех четырех атомов.
Теперь разберемся с общим количеством валентных
электронов: ион
содержит пять электронов азота, по шесть у трех
атомов кислорода и еще один, придающий заряд иону
в целом, итого двадцать четыре. Из них шесть
электронов требуется для образования трех
одинарных связей, двенадцать электронов
расположены по периметру молекулы на гибридных
орбиталях (по две электронные пары у каждого
атома кислорода), остается шесть электронов на
четыре те самые р-орбитали, не участвующие в
гибридизации. Единственное возможное в данном
случае разумное объяснение – это обобществление
всеми атомами своих электронов в единое
электронное облако (рис. 7). Этому способствуют
малые радиусы атомов и малые межатомные
расстояния. А симметрия обычно энергетически
выгодна и поэтому повышает устойчивость
конструкции в целом. Это не единственный случай
обобществления электронов несколькими атомами,
похожее «коллективное электронное хозяйство»
встречается в органической химии, например в
ароматических соединениях.
Вернемся, однако, к предсказаниям свойств
азотной кислоты, исходя из представлений о
структуре молекулы. Очевидная выгодность
пребывания в виде иона объясняет не только
высокую степень диссоциации кислоты в водном
растворе, но и возможность диссоциации безводной
кислоты. И именно диссоциация определяет
физические свойства этого вещества.
Физические свойства азотной кислоты
Соединение ионизированное, пусть даже и
частично, сложно перевести в газ. Таким образом,
температура кипения должна бы быть достаточно
высокой, однако при такой небольшой молекулярной
массе (и из-за высокой подвижности) температура
плавления высокой быть не должна. Следовательно,
агрегатное состояние при 20 °С – жидкое.
Что касается растворимости в воде, то, как и
многие другие полярные жидкости, азотная кислота
легко смешивается с водой в любых соотношениях.
Чистая азотная кислота бесцветна и не имеет
запаха. Однако из-за разложения на кислород и
оксид азота(IV), который в ней же и растворяется,
можно сказать, что обычная концентрированная
азотная кислота имеет желтобурый цвет и
характерный для NO2 резкий запах.
Посмотрим, как влияет строение молекулы азотной
кислоты на ее химические свойства.
Химические свойства азотной кислоты
Главное, что мы должны отметить, – наличие
высшей степени окисления атома азота
ограничивает свойства азотной кислоты, с
окислителями она не реагирует. Зато с
восстановителями, в первую очередь с металлами,
она реагирует нетрадиционно и разнообразно.
1. Реакции с металлами. С металлами
азотная кислота реагирует как сильный
окислитель даже в разбавленных растворах (в
отличие от серной кислоты, проявляющей свои
окислительные свойства только в
концентрированном виде). Образуется обычно
нитрат металла, но вместо водорода выделяются
газообразные соединения азота: NО2, NО, N2O,
N2 или аммиак, который в кислой среде сразу
переходит в ион аммония. В принципе при реакции
металла с азотной кислотой образуется весь этот
«букет» газов, но в зависимости от металла и
концентрации кислоты те или иные компоненты
будут превалировать.
Так, в лабораторных условиях оксид азота(II)
обычно получают при взаимодействии медных
стружек с азотной кислотой плотностью 1,2 г/см3,
т. е. при обработке меди разбавленной кислотой в
газообразных продуктах реакции явно превалирует
именно этот оксид:
А вот при реакции азотной кислоты той же
плотности (а следовательно, и концентрации) с
железом содержание оксида азота(II) в смеси
составляет только 40% – меньше половины, а
остальные 60% равномерно распределены между
нитратом аммония, азотом, оксидом азота(I) и
оксидом азота(IV) (рис. 8).
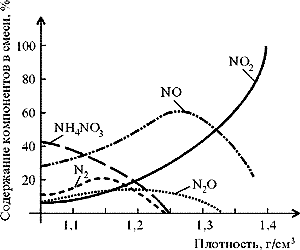 |
Рис. 8.
|
Следует отметить такой интересный и
жизненно важный факт, что со 100%-й азотной
кислотой ни железо, ни алюминий не реагируют
(следовательно, ее можно хранить и перевозить в
цистернах и других емкостях из этих металлов).
Дело в том, что эти металлы покрыты прочными
пленками оксидов, нерастворимых в чистой
кислоте. Для проявления кислотных свойств нужно,
чтобы кислота заметно диссоциировала, а для
этого в свою очередь требуется вода.
2. Реакции с неметаллами. С кислородом и
озоном азотная кислота не реагирует.
3. Реакция с водой не происходит. Вода
лишь способствует диссоциации кислоты.
4. Реакции с кислотами. Азотная кислота
не реагирует с другими кислотами по типу реакций
обмена или соединения. Однако вполне способна
реагировать как сильный окислитель. В смеси
концентрированных азотной и соляной кислот
протекают обратимые реакции, суть которых можно
обобщить уравнением:
Образующийся атомарный хлор очень активен и
легко отбирает электроны у атомов металлов, а
имеющийся «под боком» хлорид-ион образует
устойчивые комплексные ионы с получающимися
ионами металлов. Все это позволяет перевести в
раствор даже золото. По той причине, что золото –
«царь металлов», смесь концентрированных
азотной и соляной кислот называют царской
водкой.
Концентрированная серная кислота как сильное
водоотнимающее средство способствует реакции
разложения азотной кислоты на оксид азота(IV) и
кислород.
5. Реакции с основаниями и с основными
оксидами. Азотная кислота – одна из сильных
неорганических кислот и, естественно, со
щелочами реагирует. Реагирует она также и с
нерастворимыми гидроксидами, и с основными
оксидами. Этим реакциям способствует еще и то
обстоятельство, что все соли азотной кислоты
имеют хорошую растворимость в воде,
следовательно, продукты реакции не будут мешать
ее протеканию.
Физические свойства соединений NO, NO2
и HNO3 в цифрах
Оксид азота(II) NO. Молярная масса 30 г/моль.
Температура плавления равна –164 °С,
температура кипения –154 °С. Плотность
газообразного NО при нормальных условиях (0 °С,
1 атм) 1,3402 г/л. Растворимость при атмосферном
давлении и 20 °С равна 4,7 мл газа NO на 100 г воды.
Оксид азота(IV) NO2. Молярная масса 46
г/моль. Температура плавления –11 °С,
температура кипения 21 °С. Плотность
газообразного NO2 при н. у. 1,491 г/л.
Растворимость – при условии, что этот оксид
сначала реагирует с водой на воздухе, а потом еще
и растворяется в получившейся азотной кислоте, –
можно считать неограниченной (вплоть до
образования 60%-й HNO3).
Поскольку оксид азота(IV) активно димеризуется
(при 140 °С он целиком находится в виде мономера
NO2, однако при 40 °С мономера остается уже
около 30%, а при 20 °С он практически весь
переходит в димер N2O4), то физические
свойства относятся скорее к димеру, чем к
мономеру. Именно этим можно объяснить достаточно
высокую температуру кипения (N2O4
достаточно тяжелая молекула). О степени
димеризации можно судить по цвету: мономер
интенсивно окрашен, а димер бесцветен.
Азотная кислота HNO3. Молярная масса 63
г/моль. Температура плавления –41,6 °С,
температура кипения 83 °С. Плотность жидкой
100%-й кислоты 1,513 г/см3. Растворимость
неограниченная, иными словами, кислота и вода
смешиваются в любых соотношениях. Стоит
отметить, что растворы азотной кислоты кипят при
температурах выше температур кипения чистых
воды и кислоты. При максимальной температуре
(122 °С) кипит 68,4%-й раствор, при этом процентный
состав раствора и пара одинаков.
Смеси веществ, для которых состав пара при
кипячении соответствует составу жидкости,
называют азеотропными или нераздельнокипящими.
(Слово «азеотроп» произошло от греч. – киплю,
– изменение,
– отрицательная приставка.) Для
более низких концентраций кислоты характерно
увеличение количества воды в паре по сравнению с
раствором, что приводит к концентрированию
раствора. При более высоких концентрациях,
наоборот, состав пара обогащен кислотой.
Химические свойства соединений азота
(дополнение)
Как и всякие другие вещества, содержащие атом с
промежуточной степенью окисления, оксиды
азота(II) и (IV) в отличие от азотной кислоты могут
выступать и как окислители, и как восстановители,
в зависимости от партнера по реакции. Однако
многие из этих реакций «неактуальны» и
соответственно слабо изучены.
Из «актуальных» реакций стоит назвать реакцию
оксида азота(IV) с оксидом серы(IV) в присутствии
воды:
Актуальна эта реакция потому, что
присоединение кислорода к оксиду серы(IV)
протекает только при высоких температурах и в
присутствии катализатора, в то время как
присоединение кислорода к оксиду азота(II)
происходит при обычных условиях. Таким образом,
оксид азота(IV) как бы просто помогает оксиду серы
присоединить кислород. Протекает эта реакция при
обычных условиях (дополнительного давления в
смеси и нагревания не требуется).
Оксид азота(II) тоже реагирует с оксидом
серы(IV), однако при совсем других условиях: или
при давлении в 500 атмосфер (!), тогда получаются
оксид серы(VI) и азот, или в водном растворе, тогда
получаются серная кислота и оксид азота(I).
Оксид азота(I). Имеет слабый приятный запах и
сладковатый вкус. С кислородом, водой, растворами
кислот и щелочей не реагирует. Разлагается на
элементы при температуре выше 500 °С, иными
словами, достаточно устойчив.
Строение молекулы интересное: линейная молекула
О=N=N, в которой центральный атом азота
четырехвалентен. Он образует две двойные связи:
одну – с кислородом по типичной схеме создания
ковалентной связи (два электрона азота, два
электрона кислорода), другую – с атомом азота
(который два из своих трех неспаренных
электронов спаривает и образует за счет этого
пустую орбиталь), одна из связей – ковалентная,
вторая – донорно-акцепторная (рис. 9).
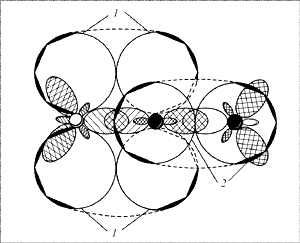 |
Рис. 9.
|
Оксид азота(III). Состоит из NО и NO2,
спаривших свои неспаренные электроны. Начинает
разлагаться на соответствующие газы уже при
плавлении (–101 °С).
Оксид азота(V). Состоит из двух групп NO2,
соединенных через кислород. Несколько более
устойчивое соединение, чем оксид азота(III),
начинает разлагаться при комнатной температуре.
Часть связей в нем, естественно,
донорно-акцепторные. И никаких «пятивалентных
азотов».
К химическим свойствам азотной кислоты следует
добавить, что она прекрасно реагирует с
неметаллами, которые может окислить. Так,
концентрированная азотная кислота реагирует и с
серой, и с фосфором, и с углем, образуя при этом
серную, фосфорную и угольную кислоты
соответственно.
Интересны и важны реакции азотной кислоты с
органическими веществами. Например, при
замещении трех атомов водорода в толуоле на
группы NO2 образуется тринитротолуол (или
просто тол) – взрывчатое вещество.
Экологические свойства оксидов азота и
азотной кислоты
Оксид азота(I) относительно инертен, а
потому «экологически нейтрален». Однако на
человека он оказывает наркотическое действие,
начиная от просто веселья (за что он и был прозван
«веселящим газом») и заканчивая глубоким сном,
что нашло свое применение в медицине. Интересно,
что он безвреден, и для медицинского наркоза
применяют смесь оксида азота(I) с кислородом в
таком же соотношении, что и соотношение азота и
кислорода в воздухе. Наркотическое действие
снимается сразу после прекращения вдыхания
этого газа.
Два других устойчивых оксида азота легко
переходят один в другой, затем в кислоты, а затем
в анионы и
. Таким образом, эти
вещества представляют собой естественные
минеральные удобрения, правда, если находятся в
естественных количествах. В «неестественных»
количествах эти газы редко попадают в атмосферу
в одиночестве. Как правило, образуется целый
«букет» ядовитых соединений, которые действуют
комплексно.
Например, всего один завод азотных удобрений
выбрасывает в воздух кроме оксидов азота,
азотной кислоты, аммиака и пыли от удобрений еще
и оксиды серы, соединения фтора, некоторые
органические соединения. Ученые выясняют
устойчивость различных трав, кустов и деревьев к
подобным «букетам». Уже известно, что, к
сожалению, ель и сосна неустойчивы и быстро
погибают, однако белая акация, канадский тополь,
ивы и некоторые другие растения могут
существовать в таких условиях, более того, они
способствуют удалению из воздуха этих веществ.
Сильное отравление оксидами азота можно
получить в основном при авариях на
соответствующих производствах. Ответная реакция
организма будет разной из-за различия в
свойствах этих газов. «Едкий» NО2 в первую
очередь действует на слизистые оболочки
носоглотки, глаз, вызывает отек легких; NО, как
малорастворимое в воде и не едкое вещество,
проходит через легкие и попадает в кровь, вызывая
нарушения в центральной и периферийной нервных
системах. Оба оксида реагируют с гемоглобином
крови, хотя и по-разному, но с одинаковым
результатом – гемоглобин перестает переносить
кислород.
Экологические свойства азотной кислоты
складываются из двух «половинок». Как сильная
кислота, она разрушающе действует не только на
живые ткани (кожу человека, лист растения), но и на
почву, что достаточно актуально – кислотные
(из-за присутствия оксидов азота и серы) дожди,
увы, не редкость. При попадании кислоты на кожу
возникает химический ожог, который болезненнее и
заживает значительно дольше, чем термический.
Это были основные экологические свойства катиона
водорода.
Перейдем к изучению аниона . При действии сильной кислоты на
передний план выдвигаются именно кислотные
свойства, поэтому свойства аниона лучше
рассмотреть на примере солей.
Взаимодействие нитрат-иона с фауной и флорой.
Дело в том, что нитрат-ион – неотъемлемая часть
круговорота азота в природе, он в ней всегда
присутствует. В обычных условиях и в
разбавленных растворах устойчив, слабо
проявляет окислительные свойства, не осаждает
катионы металлов, тем самым способствуя
транспортировке этих ионов с раствором в почве,
растениях и т. п.
Нитрат-ион становится ядовитым только в больших
количествах, нарушающих баланс других веществ.
Например, при избытке нитратов в растениях
уменьшается количество аскорбиновой кислоты.
(Стоит напомнить, что живой организм настолько
тонко организован, что любое вещество в больших
количествах нарушает равновесие и,
следовательно, становится ядовитым.)
Растения и бактерии используют нитраты для
построения белков и других необходимых
органических соединений. Для этого надо
перевести нитрат-ион в ион аммония. Эта реакция
катализируется ферментами, содержащими ионы
металлов (меди, железа, марганца и др.). Из-за
гораздо большей ядовитости аммиака и иона
аммония в растениях хорошо отработана и обратная
реакция перевода иона аммония в нитрат.
Животные не умеют строить все необходимые им
органические соединения из неорганических –
отсутствуют соответствующие ферменты. Однако
микроорганизмы, живущие в желудке и кишечнике,
этими ферментами обладают и могут переводить
нитрат-ион в нитрит-ион. Именно нитрит-ион и
действует как отравитель, переводя железо в
гемоглобине из Fe2+ в Fe3+.
Соединение, содержащее Fe3+ и называемое
метгемоглобином, слишком прочно связывает
кислород воздуха, следовательно, не может
отдавать его тканям. В результате организм
страдает от недостатка кислорода, при этом
происходят нарушения в работе мозга, сердца и
других органов.
Обычно нитрит-ион образуется не в желудке, а в
кишечнике и не успевает перейти в кровь и
произвести все эти разрушения. Поэтому
отравления нитратами достаточно редки.
Существует, правда, и другая опасность: в нашем
организме есть много веществ, в которых атомы
водорода аммиака замещены на органические
радикалы. Такие соединения называют аминами. При
реакции аминов с нитрит-ионами образуются
нитрозамины – канцерогенные вещества:
Они действуют на печень, способствуют
образованию опухолей в легких и почках.
Интересно, что активным замедлителем реакции
образования нитрозаминов является давно нам
знакомая аскорбиновая кислота.
О.Р.ВАЛЕДИНСКАЯ
(МГУ, Москва)
Валентность химических элементов. Степень окисления химических элементов
Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
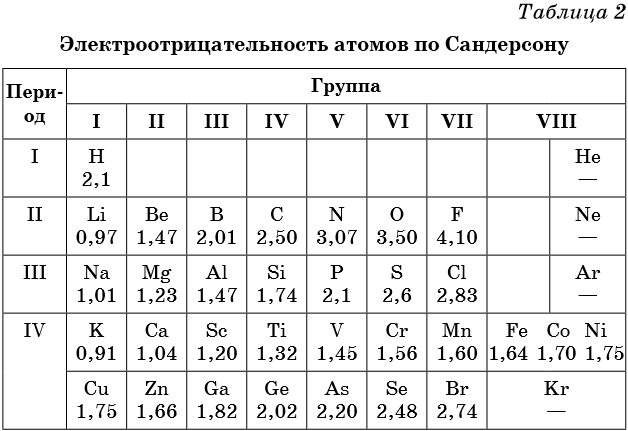
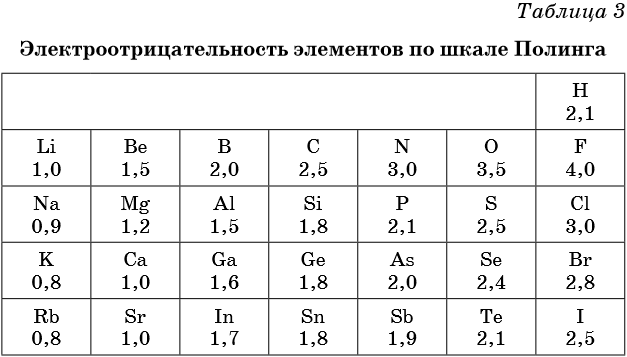
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K+ — +1, Ba2+ — +2, Br– — –1, S2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO42–. Ион SO42– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
1) HPO3
2) H3PO3
3) Li3P
4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO3
2) H3PO3
3) Li3PO4
4) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO2
2) N2O4
3) N2O
4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) NH3
2) N2H4
3) N2O5
4) HNO2
5. В каком соединении степень окисления серы равна +2?
1) Na2SO3
2) SO2
3) SCl2
4) H2SO4
6. В каком соединении степень окисления серы равна +6?
1) Na2SO3
2) SO3
3) SCl2
4) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3P
4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3PO4
4) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +3
2) –3, +5
3) +3, –3
4) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор
Ответы
Азот, соединения азота
Азот
– элемент V A
группы главной подгруппы, значит, на внешнем энергетическом
уровне у него 5 электронов. До завершения внешнего уровня ему не хватает 3 электрона,
которые он может присоединить, в этом случае степень окисления его будет равна
-3. Кроме этого, атом азота может и отдавать электроны и приобретать
положительные степени окисления. Таким образом, для атома азота в соединениях
возможны степени окисления от -3 до +5.
Рассмотрим
соединения азота.
Например,
в аммиаке – NH3
– степень окисления азота -3; в оксиде азота (I) – N2O
– степень окисления азота +1; в оксиде азота (II) – NO
– степень окисления азота +2; в азотистой кислоте – HNO2
– степень окисления азота +3; в оксиде азота (IV) – NO2
– степень окисления азота +4; в азотной кислоте – HNO3
– степень окисления азота +5.
Таким
образом, если степень окисления азота -3, то он проявляет восстановительные
свойства, если степень окисления +5, то азот проявляет окислительные
свойства, а если у азота в соединении промежуточные степени окисления: +1,
+2, +3, +4, то он может проявлять и окислительные, и восстановительные
свойства.
Азот
входит в состав воздуха, где его объёмная доля составляет
78%, он входит в состав земной коры и живых организмов. В космосе азот занимает
по распространённости четвёртое место, вслед за водородом, гелием и кислородом.
Азот
входит и в состав чилийской селитры – NaNO3
– это неорганическое вещество образовалось из остатков птичьего помёта в условиях
сухого и жаркого климата. Широко распространена и калийная селитра – KNO3,
встречающаяся в Индии.
Азот
входит в состав всех белков, а белок просто необходим
для жизни. Человек получает белок из растительной и животной пищи, а животные получают
белок, в основном, из растений. А сами растения являются источником пополнения
азота. Поэтому в природе постоянно происходит круговорот азота.
Так
как азот входит в состав органических соединений, то он недоступен для растений.
Но, в результате жизнедеятельности определённой группы бактэрий, органические
соединения превращаются в неорганические – минеральные – это соли аммония и
нитраты. И уже эти неорганические вещества усваиваются растениями. Затем
растениями, которые усвоили азот, питаются животные и из растений получают
необходимый белок.
Большую
роль в фиксации азота играют клубеньковые бактерии, которые живут в
клубеньках бобовых растений (клевера, гороха, люпина). Они усваивают
атмосферный азот и превращают его в соединения, которые доступные растениям.
Кроме
этого, соединения азота в почве пополняются за счёт грозовых ливней.
Сначала из азота и кислорода образуется оксид азота (II), который под действием
кислорода воздуха превращается в оксид азота (IV). Этот оксид реагирует с водой
в присутствии кислорода воздуха и получается азотная кислота. Кислота
затем вступает во взаимодействие с соединениями натрия, кальция и калия,
которые находятся в почве, и образует соли – селитры, которые нужны для питания
растений.
Простое
вещество азот состоит из двухатомных молекул – N2.
В молекуле азота атомы связаны между собой тройной ковалентной неполярной
связью. Эта связь очень прочная, поэтому азот является малоактивным
веществом.
Азот
является бесцветным газом, не имеет запаха и вкуса, немного легче воздуха.
Не сжижается при обычной температуре, плохо растворим в воде, его температура
плавления -210 0C,
а температура кипения -196 0C.
В
лаборатории азот получают разложением нитрита аммония
при слабом нагревании.
Азот
относительно инертен в химических реакциях. Он не реагирует ни с
кислотами, ни с водой, ни со щелочами.
При
обычных условиях азот реагирует только с литием.
При этом образуется нитрид лития.
Литий
повышает свою степень окисления с 0 до +1, а азот понижает с 0 до -3.
Каждый атом алюминия отдает по 6 электронов молекуле азота, при этом литий
является восстановителем, а азот окислителем.
С
другими металлами азот реагирует только при высоких температурах.
Например,
в реакции с магнием образуется нитрид магния. Магний изменяет свою степень
окисления с 0 до +2, а азот понижает с 0 до -3. Каждый атом магния отдаёт по 3
электрона молекуле азота. Магний в реакции является восстановителем, а азот –
окислителем.
При
высоких температуре, давлении и в присутствии катализатора
азот реагирует с водородом, образуя при этом аммиак. В этой реакции азот
понижает свою степень окисления с 0 до -3, а водород повышает с 0я до +1. Азот
является окислителем, а водород восстановителем.
Как
видите, это реакция соединения, так как из двух простых веществ
образуется одно сложное, реакция экзотермическая, так как протекает с
выделением теплоты, обратимая, то есть идёт как в прямом, так и в
обратном направлении, каталитическая, потому что в реакции присутствует
катализатор – железо. Реакция является окислительно-восстановительной,
потому что происходит изменение степеней окисления, реакция гомогенная,
так как вступающие в химическую реакцию вещества и продукты реакции в одном
агрегатном состоянии – газообразном.
При
высокой температуре азот соединяется с кислородом,
образуя оксид азота два.
В
этой реакции азот повышает свою степень окисления с 0 до +2, а кислород
понижает с 0 до -2. Азот является восстановителем, а кислород – окислителем.
Так
как эта реакция идёт с изменением степеней окисления, то она является окислительно-восстановительной,
это реакция соединения, потому что из двух простых веществ образуется
одно сложное. Реакция обратимая, идёт в прямом и обратном
направлении, эндотермическая, так как теплота поглощается, реакция некаталитическая,
потому что не требует участия катализатора, является гомогенной, так
как все вещества находятся в газообразном состоянии.
Следует
отметить, что в реакциях с металлами и водородом азот проявляет
окислительные свойства, а в реакциях с кислородом – восстановительные.
Основная
область применения азота – производство аммиака и азотной кислоты. Азот
применяют также для создания инертной среды при сушке взрывчатых веществ, при
хранении ценных произведений живописи и рукописей. Азотом раньше
наполняли электрические лампы. Жидкий азот используют в охладительных системах.
В
медицине чистый азот применяют в качестве инертной среды
при лечении туберкулёза лёгких, а жидкий азот – при лечении заболеваний
позвоночника и суставов.
В
1772 году английский учёный Резерфорд и шведский исследователь Шееле
в экспериментах по сжиганию веществ обнаружили газ, не поддерживающий
дыхание и горение. Позднее, в 1787 году, Лавуазье установил
наличие в воздухе газа, не поддерживающего дыхания и горения. Он дал название
этому газу «азот», означающее «безжизненный» (от латинского а –
нет и зоэ – жизнь). В 1790 году Шапталь дал азоту другое
название – нитрогениум – означающее «рождающий селитру».
Решим
задачу. Определим массу соединения, которое образуется при нагревании
металлического магния массой 7,2 г в азоте объёмом 10 л при
нормальных условиях.
В
условии задачи нам дана масса магния и объём азота. Найти необходимо массу
образовавшегося соединения, то есть массу нитрида магния. Найдём количество
вещества магния, для этого необходимо массу магния разделить на его молярную
массу. То есть 7,2 г разделим на 24 г/моль, получим 0,3 моль, теперь найдём
количество вещества азота, для этого нужно объём азота разделить на молярный
объём. Для этого разделим 10 л на 22,4 л/моль, получается 0,446 моль. По
уравнению реакции видно, что соотношение моль магния и азота составляет 3 :
1. Следовательно, количество вещества азота должно быть в три раза меньше
количества вещества магния, то есть 0,1 моль. В результате вычислений мы
получили количество вещества азота, равное 0,446 моль. Поэтому азот находится в
избытке, и количество вещества нитрида магния находим по магнию.
Получается,
что количество вещества нитрида магния будет 0,1 моль, то есть 0,3 умножим на 1
и разделим на 3 и получится 0,1 моль. Найдём молярную массу нитрида магния. Для
этого относительную атомную массу магния (24) умножим на 3 и прибавим
относительную атомную массу азота (14), умноженную на 2, получается 100 г/моль.
Найдём массу этого вещества. Для этого следует количество вещества умножить на
молярную массу, поэтому 0,1 моль умножаем на 100 г/моль и получим 10 г.
Таким образом масса нитрида магния будет равна десять
г.
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов.
Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО |
Значение постоянной СО этого элемента |
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr |
+1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd |
+2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
Химический элемент |
Номер группы |
Высшая степень окисления |
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | 0 |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF2). Расставим известные степени окисления:
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH4+ (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH4+ , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH4+ и анионами Cr2O72-.
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y:
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной (
) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
em>Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
4) В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония NH4+, азотная кислота и д.р).
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s-орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.