Классификация гидроксидов и оснований
Материал по химии
Основания и гидроксиды.
Для того, чтобы разбираться в классификации, сначала нужно понять, что такое основание и чем оно отличается от других веществ. Перечислим несколько оснований:
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа
Все три примера относятся к основаниям, но в названии значится, что это гидроксиды. В чем разница между этими понятиями?
Гидроксиды – это вещества, в состав которых какой-либо элемент имеет связь с гидроксильной группой (‒ОН). Но не все гидроксиды – это основания: кислоты, например, тоже являются гидроксидами.
Классификация гидроксидов и оснований
Основные и ксилотные кидроксиды
Таким образом, все основания – это гидроксиды, но не все гидроксиды – это основания. Ввиду того, что группа гидроксидов очень разнообразна, её принято делить на три подгруппы.
Таб. «Классификация гидроксидов»
|
Гидроксид |
||
|
Основный |
Амфотерный |
Кислотный |
|
В состав входят гидроксогруппа (-ы) и металл в степени окисления «+1» или «+2» за исключением Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппы и металл в степени окисления «+3» или «+4», а также Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппа (-ы) и неметалл, либо гидроксогруппа (-ы) и металл в степени окисления «+5», «+6» или «+7» |
|
Общий состав: ЭОН |
Общий состав: ЭОН/НЭО |
Общий состав: НЭО |
|
Примеры: Cr(OH)2 KOH Mg(OH)2 |
Примеры: Cr(OH)3/HCrO2 Mn(OH)4/H2MnO3 Al(OH)3/HAlO2 |
Примеры: HNO3 H3PO4 HMnO4 |
Э – элемент. К основным гидроксидам так же относят гидроксид аммония – NH4OH, хотя правильнее его записывать как гидрат аммония – NH3·H2O.
Амфотерные гидроксиды имеют промежуточный характер между основными и кислотными, поэтому имеют обе формы написания.
Задание в формате ЕГЭ с ответом:
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: амфотерного гидроксида, двухосновного основания, кислотного гидроксида. Запишите соответствующую последовательность цифр.
1) NaOH 2) NH3*H2O 3) HMnO4 4) Be(OH)2 5) KMnO4 6) Na[Al(OH)4] 7) MnO2 Ca(OH)2
9) KOH
Пример задания из КИМ ЕГЭ:
Среди перечисленных веществ выберите три формулы, соответствующие амфотерным гидроксидам:
- H2Cr2O7
- Be(OH)2
- Al(OH)3
- Fe(OH)2
- Ga(OH)3
- H2SO4
Задание по образцу ФИПИ:
Кислотный гидроксид может образовать следующий элемент:
- натрий
- мышьяк
- алюминий
- хлор
- молибден
- цинк
Кислотные гидроксиды образуют неметаллы в любой степени окисления, поэтому подходит мышьяк и хлор, а также металлы в степени окисления +5 и выше, поэтому подходит молибден – он находится в шестой группе Периодической системы, значит, может образовать ион со степенью окисления +6
Перевод формулы амфотерного гидроксида из основной формы в кислотную.
Пример 1.
-
Возьмём любой амфотерный гидроксид: Al(OH)3;
-
Поменяем порядок элементов на кислотную форму (водород → элемент → кислород) без учета индексов основной формы: HAlO;
-
Расставим степени окисления:
-
Молекула должна быть электронейтральной (количество положительных и отрицательных зарядов должно быть равным), для этого кислорода должно быть в два раза больше, поэтому после него ставим индекс «2»: HAlO2
Пример 2.
-
Zn(OH)2;
-
HZnO
-
Согласно этой формуле после кислорода придется поставить индекс «1,5», но индексы могут быть выражены только целыми числами, поэтому сначала приведем количество положительных зарядов к четному значению, домножив элемент с нечетной степенью окисления (водород) на 2, получим формулу: H2ZnO, она пока всё равно не является электронейтральной, сумма её зарядов может быть выражена следующим уравнением: +2+2‒2 = +2, а должно быть = 0
|
+ |
+2 |
‒2 |
|
H2 |
Zn |
O |
|
+2 |
+2 |
‒2 |
|
+4 |
‒2 |
Чтобы количество отрицательных зарядов тоже стало равно четырем, количество кислорода нужно умножить вдвое, поставив после него индекс «2». Получается формула H2ZnO2
Таб. «Общие формулы амфотерных гидроксидов в зависимости от степени окисления металла в них»
|
Степень окисления |
+2 |
+3 |
+4 |
|
Основная формула |
Me(OH)2 |
Me(OH)3 |
Me(OH)4 |
|
Кислотная формула |
H2MeO2 |
HMeO2 |
H2MeO3 |
|
Пример |
H2BeO2 |
HCrO2 |
H2MnO3 |
Me – металл.
Классификация основных гидроксидов (оснований) по количеству гидроксо-групп.
|
Основания |
|
|
Однокислотные |
Двукислотные |
|
LiOH NaOH KOH |
Ca(OH)2 Fe(OH)2 Ba(OH)2 |
Однокислотные основания при диссоциации образуют лишь один гидроксид ион:
LiOH ↔ Li+ + OH‒
NaOH ↔ Na+ + OH‒
Двукислотные основания при диссоциации образуют два гидроксид-иона:
Ca(OH)2 ↔ Ca2+ + 2OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Основные гидроксиды не могут быть трёхкислотными или четырёхкислотными, так как в них металл будет иметь степень окисления «+3» или «+4», а это уже будет не основанием, а амфотерным гидроксидом.
Почему количество гидроксильных групп называется кислотностью? Потому что на нейтрализацию оснований требуется протон водорода из кислоты. Для нейтрализации однокислотных оснований потребуется один протон водорода, а на нейтрализацию двукислотного основания – два протона водорода и так далее. Например:
Молекулярное уравнение (МУ): NaOH + HCl = NaCl + H2O
Полное ионное уравнение (ПИУ): Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращение одинаковых ионов: Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращенное ионное уравнение (СИУ): OH‒ + H+ = H2O
На нейтрализацию однокислотного основания потребовался один протон водорода из соляной кислоты.
Классификация оснований по силе
Основания также можно поделить на сильные и слабые. Сильные диссоциируют очень быстро, даже двухосновные распадаются на ионы на столько быстро, что можно не учитывать ступенчатость этого процесса:
LiOH ↔ Li+ + OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Слабые основания диссоциируют очень медленно, ступенчато:
Fe(OH)2 ↔ FeOH+ + OH‒ (первая ступень)
FeOH+ ↔ Fe2+ + OH‒ (вторая ступень)
Сильные основания растворимы или малорастворимы (исключение: гидроксид аммония будучи растворимым остаётся слабым основанием) и называются щелочами. Слабые основания нерастворимы.
Таб. «Сильные и слабые основания»
|
Основания |
|
|
Сильные (щелочи) |
Слабые |
|
Растворимы |
Нерастворимы (искл. NH4OH) |
|
Гидроксиды металлов IA-подгруппы, а также кальция, стронция и бария |
Все остальные |
|
Примеры: LiOH, NaOH, KOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Примеры: Mg(OH)2, Fe(OH)2, CuOH, Cr(OH)2, Mn(OH)2, Cu(OH)2 |
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Гидроксиды – соединения элементов (кроме фтора и кислорода) с гидроксогруппами ОН‑.
В гидроксидах степень окисления элемента всегда положительная (от +1 до +7).
Делятся на
1. основные (основания),
2. кислотные (кислоты),
3. амфотерные гидроксиды.
СВЯЗЬ МЕЖДУ ОКСИДАМИ И ГИДРОКСИДАМИ
ОСНÓВНЫЕ ГИДРОКСИДЫ (ОСНОВАНИЯ)
Основания – сложные вещества, содержащие в своем составе гидроксид-ионы ОН- и при диссоциации образующие в качестве анионов только эти ионы.
НОМЕНКЛАТУРА ИЮПАК
«гидроксид» + название металла (или аммония) в родительном падеже.
Если металл образует несколько оснований, то указывается валентность в скобках сразу после названия элемента.
Например,
NaOH – гидроксид натрия;
Fe(OH)3 – гидроксид железа (III);
Ca(OH)2 – гидроксид кальция;
CuOH – гидроксид меди (I).
Применяются тривиальные названия для некоторых важных и часто применяемых соединений.
Например:
NaOH – едкий натр, каустическая сода;
Ca(OH)2 – известковая вода (раствор Ca(OH)2 в воде), известковое молочко, гашеная известь;
KOH – едкое кали;
Ba(OH)2 – баритовая вода (раствор Ba(OH)2 в воде) и др.
КЛАССИФИКАЦИЯ ОСНОВАНИЙ ПО АГРЕГАТНОМУ СОСТОЯНИЮ
1. Жидкие (гидроксид аммония NH4OH)
2. Твердые (все остальные)
КЛАССИФИКАЦИЯ ОСНОВАНИЙ ПО РАСТВОРИМОСТИ В ВОДЕ
1. РАСТВОРИМЫЕ (ЩЕЛОЧИ)
гидроксиды металлов первой группы главной подгруппы: LiOH, NaOH, KOH, RbOH, CsOH
гидроксиды металлов второй группы главной подгруппы, начиная с кальция: Ca(OH)2, Sr(OH)2, Ba(OH)2
2. НЕРАСТВОРИМЫЕ
Все остальные основные гидроксиды металлов
КИСЛОТЫ
Кислоты – сложные вещества, содержащие в своем составе ионы Н+ или при взаимодействии с водой образующие в качестве катионов только эти ионы.
Кислотные гидроксиды называют кислородсодержащими кислотами или оксокислотами.
Кислотные гидроксиды (кислоты) образованы элементами с неметаллическими свойствами.
Примеры:
АМФОТЕРНЫЕ ГИДРОКСИДЫ
образованы элементами с амфотерными свойствами. Это электролиты при диссоциации которых образуются как катионы водорода Н⁺, так и анионы ОН⁻;
Типичные амфотерные гидроксиды: Be(OH)2, Pb(OH)2, Al(OH)3, Zn(OH)2, Cr(OH)3, Fe(OH)3
Амфотерные гидроксиды проявляют свойства основных и кислотных гидроксидов; образуют два вида солей, в которых амфотерный элемент входит в состав либо катионов солей, либо их анионов.
Для элементов, имеющих несколько степеней окисления, чем выше степень окисления, тем более выражены кислотные свойства гидроксидов (и/или соответствующих оксидов).
Возможные степени окисления элементов
Перед тем как начать писать окислительно-восстановительные реакции, необходимо знать какие степени окисления может проявлять тот или иной химический элемент. Рассмотрим степени окисления, знание которых необходимо для успешной сдачи ЕГЭ.
Элементы с постоянными степенями окисления в сложных соединениях:
| Степень окисления | Элементы | Примеры соединений | Названия соединений |
|---|---|---|---|
| -1 | F | NaF OF2 |
Фторид натрия Фторид кислорода |
| +1 | Все металлы 1-ой группы главной подгруппы (Li-Fr) | Na2O KH |
Оксид натрия Гирид калия |
| +2 | Все металлы 2-ой группы главной подгруппы (Be-Ra), а также Zn и Cd | BeO CaH2 |
Оксид бериллия Гидрид кальция |
| +3 | Al | Al2O3 Al(OH)3 Al2(SO4)3 |
Оксид алюминия Гидроксид алюминия Сульфат алюминия |
Элементы с переменными степенями окисления:
1. Водород
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | H2 | Водород (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| +1 | H2O H2O2 H2SO4 KOH NaHSO3 |
Вода Пероксид водорода Серная кислота Гидроксид калия Гидросульфит натрия |
В таких соединениях, как вода, пероксид водорода, все кислоты, основания, кислые соли, все органические соединения |
| -1 | NaH CaH2 |
Гидрид натрия Гидрид кальция |
Только с металлами водород может проявлять степень окисления -1 |
2. Кислород
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | O2 | Кислород (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| -2 | H2O Na2O H2SO4 KOH NaHSO3 |
Вода Оксид натрия Серная кислота Гидроксид калия Гидросульфит натрия |
В таких соединениях, как вода, все оксиды, кислоты, основания, кислые соли, все органические соединения |
| -1 | H2O2 Na2O2 BaO2 |
Пероксид водорода Пероксид натрия Пероксид бария |
В пероксиде водорода и всех других пероксидах |
| -1/2 | KO2 | Супероксид калия (надпероксид калия) |
Во всех супероксидах |
| -1/3 | KO3 Sr(O3)2 |
Озонид калия Озонид стронция |
Во всех озонидах |
| +1 | O2F2 | Дифторид кислорода |
Положительные степени окисления кислород проявляет только в соединениях с фтором |
| +2 | OF2 | Фторид кислорода |
3. Сера
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | S8 | Сера | Светло-желтый порошок; нерастворим в воде, тяжелее её, но в воде не тонет, плавает на её поверхности, так как ею не смачивается. Молекулы S8 образуют молекулярную кристаллическую решетку. Сера существует в виде нескольких аллотропных модификаций: ромбическая, моноклинная, пластическая. |
| -2 | H2S CaS |
Сероводородная кислота Сульфид кальция |
Все сульфиды |
| -1 | FeS2 | Персульфид железа (II) (пирит, серный колчедан, железный колчедан) |
Единственное соединение со ст. ок. -1 |
| +4 | SO2 H2SO3 CaSO3 |
Оксид серы (IV) Сернистая кислота Сульфит кальция |
В таких соединениях как оксид серы (IV), сернистой кислоте и всех её солях |
| +6 | SO3 H2SO4 CaSO4 |
Оксид серы (VI) Серная кислота Сульфат кальция |
В таких соединениях как оксид серы (VI), серной кислоте и всех её солях |
4. Азот
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | N2 | Азот (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| -3 | NH3 Na3N Ca3N2 |
Аммиак Нитрид натрия Нитрид кальция |
В таких соединениях, как аммиак и все нитриды |
| -2 | N2H4 | Гидразин | Степени окисления -2 и -1 встречаются только в органических соединениях |
| -1 | NH2OH | Гидроксиламин | |
| +1 | N2O | Оксид азота (I) | Азот проявляет положительные степени окисления только в соединениях с кислородом и фтором |
| +2 | NO | Оксид азота (II) | |
| +3 | N2O3 HNO2 NF3 |
Оксид азота (III) Азотистая кислота Фторид азота (III) |
В таких соединениях, как оксид азота (III), азотистой кислоте и всех её солях, фториде азота (III) |
| +4 | NO2 | Оксид азота (IV) | Смешанный оксид азота (IV) |
| +5 | N2O5 HNO3 |
Оксид азота (V) Азотная кислота |
В таких соединениях, как оксид азота (V), азотной кислоте и всех её солях |
5. Галогены*
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | F2 Cl2 Br2 I2 |
Фтор Хлор Бром Йод |
Светло-зеленый газ Желто-зеленый газ Темно-красная жидкость Серо-черные кристаллы |
| -1 | HF HCl HBr HI |
Фтороводород (соли кислоты: фториды) Хлороводород (соли кислоты: хлориды) Бромоводород (соли кислоты: бромиды) Йодоводород (соли кислоты: йодиды) |
Бесцветные ядовитые газы. При растворении в воде образуют соответствующие кислоты. |
| +1 | HClO HBrO HIO |
Хлорноватистая кислота (соли: гипохлориты) Бромноватистая кислота (соли: гипобромиты) Йодноватистая кислота (соли: гипоиодиты) |
В приведенных кислотах, а также всех их солях |
| +3 | HClO2 HBrO2 HIO2 |
Хлористая кислота (соли: хлориты) Бромистая кислота (соли: бромиты) Йодистая кислота (соли: иодиты) |
В приведенных кислотах, а также всех их солях |
| +5 | HClO3 HBrO3 HIO3 |
Хлорноватая кислота (соли: хлораты) Бромноватая кислота (соли: броматы) Йодноватая кислота (соли: иодаты) |
В приведенных кислотах, а также всех их солях |
| +7 | HClO4 HBrO4 HIO4 |
Хлорная кислота (соли: перхлораты) Бромная кислота (соли: перброматы) Йодная кислота (соли: периодаты) |
В приведенных кислотах, а также всех их солях |
* Для фтора только 0 и -1; At также является галогеном, но его не рассматриваем, так как в природе его практически нет.
6. Углерод**
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | C | Углерод | Аллотропные модификации: алмаз, графит, карбин (черный порошок, полимерные цепи -C=C-, =С=С=), фуллерены (темные, похожие на сажу, C60-C200) |
| +2 | CO | Оксид углерода (II) (угарный газ) |
В таких соединениях как CO, а также в некоторых органических соединениях |
| +4 | CO2
H2CO3 |
Оксид углерода (IV) (углекислый газ) Угольная кислота |
В таких соединениях как оксид углерода (IV), угольная кислота и все ее соли |
** В органических соединениях углерод проявляет все степени окисления от -4 (например, CH4) до +3 (например, CH3COOH).
7. Фосфор
| Степень окисления | Примеры соединений | Названия соединений | Тип соединения | Комментарий |
|---|---|---|---|---|
| 0 | P | Фосфор | Неметалл | В природе в свободном состоянии не встречается. Наиболее устойчивые аллотропные модификации: белый фосфор (P4, молекулярная кристаллическая решетка), красный и черный фосфор (атомные кристаллические решетки) |
| -3 | PH3 | Фосфин | Летучее водородное соединение | Бесцветный ядовитый газ с запахом чеснока |
| +1 | H3PO2 NaH2PO2 |
Фосфорноватистая кислота Гипофосфит натрия |
Кислота Средняя соль |
Только в кислоте и ее солях |
| +3 | P2O3 H3PO3 Na2HPO3 |
Оксид фосфора (III) Фосфористая кислота Фосфит натрия |
Кислотный оксид Кислота Средняя соль |
В таких соединениях, как оксид фосфора (III), фосфористая кислота и все её соли |
| +5 | P2O5 H3PO4 Na3PO4 |
Оксид фосфора (V) (Орто)фосфорная кислота Фосфат натрия |
Кислотный оксид Кислота Средняя соль |
В таких соединениях, как оксид фосфора (V), фосфорная кислота и все её соли |
8. Хром
| Степень окисления | Примеры соединений | Названия соединений | Тип соединения | Комментарий |
|---|---|---|---|---|
| 0 | Cr | Хром | Металл | Голубовато-белый металл. В обычных условиях покрыт оксидной пленкой и поэтому инертен по отношению к кислороду воздуха и воде. |
| +2 | CrO Cr(OH)2 |
Оксид хрома (II) Гидроксид хрома (II) |
Основный оксид Нерастворимое основание |
Нестабильная степень окисления, сильные восстановители |
| +3 | Cr2O3 Cr(OH)3 H3CrO3 HCrO2 NaCrO2 |
Оксид хрома (III) Гидроксид хрома (III) Хромистая кислота (соли: хромиты) Метахромистая кислота (соли: (мета)хромиты) Метахромит натрия Гексагидроксохромат (III) натрия |
Амфотерный оксид Амфотерный гидроксид Кислота Кислота Средняя соль |
Степень окисления стабильная, проявляется в оксиде, гидроксиде, хромитах и гидроксокомплексах с хромом |
| +6 | CrO3 H2CrO4 H2Cr2O7 |
Оксид хрома (VI) Хромовая кислота (соли: хроматы, желтые) Дихромовая кислота (соли: дихроматы, оранжевые) |
Кислотный оксид Кислота Кислота |
Степень окисления стабильная (соединения являются сильными окислителями) проявляется в оксиде, кислотах (хромовой, дихромовой) и их солях |
9. Железо
| Степень окисления | Примеры соединений | Названия соединений | Тип соединения | Комментарий |
|---|---|---|---|---|
| 0 | Fe | Железо | Металл | Серебристо-белый, блестящий металл |
| +2 | FeO Fe(OH)2 |
Оксид железа (II) Гидроксид железа (II) |
Основный оксид Нерастворимое основание |
Оксид черного цвета Гидроксид серо-зеленого цвета |
| +3 | Fe2O3 Fe(OH)3 HFeO2 KFeO2 K3[Fe(OH)6] |
Оксид железа (III) Гидроксид железа (III) Железистая кислота Феррит калия Гексагидроксоферрат (III) калия |
Амфотерный оксид Амфотерный гидроксид Кислота Средняя соль Гидроксокомплекс |
Оксид и гидроксид бурого цвета (цвет ржавчины) |
| +6 | K2FeO4 | Феррат калия | Средняя соль | Кислота H2FeO4 как индивидуальное вещество не выделена |
10. Медь
| Степень окисления | Примеры соединений | Названия соединений | Тип соединения | Комментарий |
|---|---|---|---|---|
| 0 | Cu | Медь | Металл | Розово-красный, пластичный металл |
| +1 | Cu2O CuOH |
Оксид меди (I) Гидроксид меди (I) |
Основный оксид |
Кирпично-красного цвета |
| +2 | CuO Cu(OH)2 |
Оксид меди (II) Гидроксид меди (II) |
Основный оксид Нерастворимое основание |
Оксид черного цвета Гидроксид голубого цвета |
11. Марганец
| Степень окисления | Примеры соединений | Названия соединений | Тип соединения | Комментарий |
|---|---|---|---|---|
| 0 | Mn | Марганец | Металл | Металл серебристо-белого цвета |
| +2 | MnO Mn(OH)2 |
Оксид марганца (II) Гидроксид марганца (II) |
Основный оксид Нерастворимое основание |
Оксид зеленого цвета Основание светло-розового цвета |
| +3 | Mn2O3 | Оксид марганца (III) | Амфотерный оксид | Коричнево-чёрные кристаллы, не растворимые в воде |
| +4 | MnO2 | Оксид марганца (IV) | Амфотерный оксид | Порошок тёмно-коричневого цвета, нерастворимый в воде |
| +6 | MnO3 K2MnO4 |
Оксид марганца (VI) Манганат калия |
Кислотный оксид Средняя соль |
Оксид тёмно-красного цвета Соль темно-зеленого цвета |
| +7 | Mn2O7 HMnO4 KMnO4 |
Оксид марганца (VII) Марганцовая кислота Перманганат калия |
Кислотный оксид Кислота Средняя соль |
Красная маслянистая жидкость Кислота и соль фиолетово-красного цвета |
12. Кремний
| Степень окисления | Примеры соединений | Названия соединений | Тип соединения | Комментарий |
|---|---|---|---|---|
| 0 | Si | Кремний | Неметалл | Две аллотропные модификации: кристаллический (серый) и аморфный (белый порошок) |
| -4 | Mg2Si | Силицид магния | Бинарное соединение | Темно-синие кристаллы (Mg2Si). Ст. окисления -4 в соединениях кремния с металлами |
| +2 | SiO | Оксид кремния (II) | Несолеобразующий оксид | Смолоподобное аморфное вещество |
| +4 |
SiO2 SiC |
Оксид кремния (IV) Силан Карборунд |
Кислотный оксид Летучее водородное соединение Бинарное соединение |
Кремнезём (SiO2) Бесцветный неустойчивый газ (SiH4) Кристаллическое вещество (SiC) Степень окисления +4 в соединениях кремния с неметалами |
В оксидах у элемента кислорода (О2) степень окисления всегда -2 (исключения — пероксиды и соединение со фтором) , в основаниях у гидроксидов соединение (ОН) имеет заряд -1 — всегда , поэтому можно легко поставить индекс, взглянув на таблицу растворимости, там написаны заряды катионов ( металлов) , в кислотах и солях можно определить с помощью той же таблицы растворимости, взглянув на заряды анионов( кислотных остатков) в кислотах водород(Н2) имеет заряд +1(всегда) , чтобы определить степень окисления у элемента , находящегося в кислотном остатке, допустим у серы в веществе (Н2SO4) , достаточно найти ст. ок в таблице (-2) и аниона SO4 и посчитать, т.к водород уже известен.
Оцени ответ


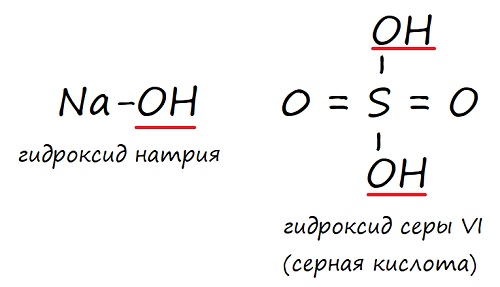
 Ca(OH)2
Ca(OH)2![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)









