В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
1.
Чем схожи и чем различаются между собой изотопы водорода?
Изотопы водорода имеют одинаковый атомный номер (т.е. одинаковое число протонов в ядре).
2.
Могут ли у разных химических элементов быть одинаковые заряды атомных ядер? А одинаковые массы? Почему?
У разных химических элементов не может быть одинаковых зарядов атомных ядер, но они могут иметь одинаковую массу. Потому что количество протонов в ядре атома одного химического элемента постоянно, а число нейтронов в ядре одного химического элемента может быть различно.
3.
Определите состав атомных ядер изотопов:
а) 2040Ca:mathrm{^{40}_{20}Ca:} протонов = 20, нейтронов = 20;
2042Ca:mathrm{^{42}_{20}Ca:} протонов = 20, нейтронов = 22;
2044Ca:mathrm{^{44}_{20}Ca:} протонов = 20, нейтронов = 24;
б) 1632S:mathrm{^{32}_{16}S:} протонов = 16, нейтронов = 16;
1634S:mathrm{^{34}_{16}S:} протонов = 16, нейтронов = 18;
1635S:mathrm{^{35}_{16}S:} протонов = 16, нейтронов = 19;
4.
Объясните причину и суть явления радиоактивности.
Причина радиоактивности — низкая устойчивость ядер некоторых нуклидов. Суть радиоактивности: неустойчивое ядро самопроизвольно распадается, превращаясь в атомы других элементов и испуская различные частицы.
5.
Чем отличается радионуклид от стабильного нуклида того же элемента?
Нуклиды делятся на стабильные и радиоактивные (радионуклиды). Стабильные нуклиды не испытывают спонтанных радиоактивных превращений из основного состояния ядра. Радионуклиды путём радиоактивных превращений переходят в другие нуклиды.
6.
Серная кислота массой 39,2 г полностью прореагировала с магнием. Рассчитайте объем (н. у.) водорода, выделившегося в результате этой реакции.
Дано:
m(H2SO4)=39.2 г;mmathrm{(H_2SO_4)}=39.2,г;
V(H2)−?;Vmathrm{(H_2)}-?;
Решение:
1) Рассчитаем химическое количество H2SO4:mathrm{H_2SO_4}: n=mM;n=dfrac{m}{M}; MM численно равна MrM_r, M=98 г/моль;M=98,г/моль;
n(H2SO4)=m(H2SO4)M(H2SO4)=39.2 г98 г/моль=0.4 моль.nmathrm{(H_2SO_4)}=dfrac{mmathrm{(H_2SO_4)}}{Mmathrm{(H_2SO_4)}}=dfrac{39.2,г}{98,г/моль}=0.4,моль.
2) Рассчитаем по уравнению реакции химическое количество H2:mathrm{H_2}:
H2SO41 моль0.4 моль+Mg=MgSO4+H21 мольx моль;mathrm{overset{0.4,моль}{underset{1,моль}{H_2SO_4}}+Mg=MgSO_4+overset{x,моль}{underset{1,моль}{H_2}}};
x=0.4 моль⋅1 моль1 моль=0.4 моль.x=dfrac{0.4,моль·1,моль}{1,моль}=0.4,моль.
3) Находим V(H2):Vmathrm{(H_2)}:
V=n⋅Vm, V(H2)=n(H2)⋅Vm=0.4 моль⋅22.4 дм3/моль=8.96 дм3.V=n·V_m,, Vmathrm{(H_2)}=nmathrm{(H_2)}·V_m=0.4,моль·22.4,дм^3/моль=8.96,дм^3.
Ответ: 8.96 дм3.8.96, дм^3.
7.
Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
Присоединяйтесь к Telegram-группе @superresheba_8,
делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!
Как вычислить число протонов в ядре изотопа
Атомы состоят из субатомных частиц — протонов, нейтронов и электронов. Протоны представляют собой положительно заряженные частицы, которые находятся в центре атома, в его ядре. Вычислить число протонов изотопа можно по атомному номеру соответствующего химического элемента.
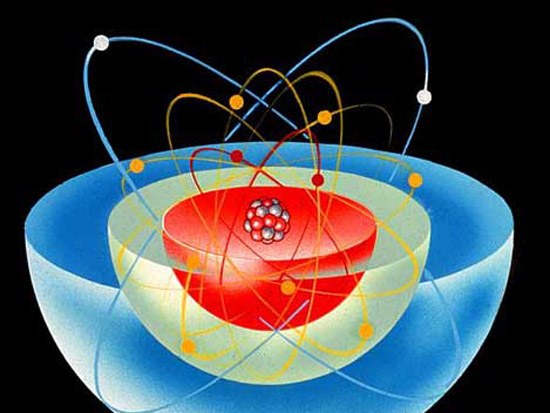
Для описания свойств атома и его структуры используется модель, известная под названием «Модель атома по Бору». В соответствии с ней структура атома напоминает солнечную систему — тяжелый центр (ядро) находится в центре, а более легкие частицы движутся по орбите вокруг него. Нейтроны и протоны образуют положительно заряженное ядро, а отрицательно заряженные электроны движутся вокруг центра, притягиваясь к нему электростатическими силами.
Элементом называют вещество, состоящее из атомов одного типа, он определяется числом протонов в каждом из них. Элементу присваивают свое имя и символ, например, водород (H) или кислород (О). Химические свойства элемента зависят от числа электронов и, соответственно, числа протонов, содержащихся в атомах. Химические характеристики атома не зависят от числа нейтронов, так как нейтроны не имеют электрического заряда. Однако их число влияет на стабильность ядра, изменяя общую массу атома.
Изотопами называют атомы отдельных элементов с различным числом нейтронов. Данные атомы химически идентичным, однако обладают разной массой, также они отличаются своей способностью испускать излучение.
Атомный номер (Z) — это порядковый номер химического элемента в периодической системе Менделеева, он определяется числом протонов в ядре. Каждый атом характеризуется атомным номером и массовым числом (А), которое равно суммарному числу протонов и нейтронов в ядре.
Элемент может иметь атомы с различным числом нейтронов, но количество протонов остается неизменным и равно числу электронов нейтрального атома. Для того, чтобы определить, сколько протонов содержится в ядре изотопа, достаточно посмотреть на его атомный номер. Число протонов равно номеру соответствующего химического элемента в периодической таблице Менделеева.
В качестве примера можно рассмотреть изотопы водорода. В природе наиболее распространены атомы водорода с одним протоном и без нейтронов. В то же время существуют изотопы водорода с одним или двумя нейтронами, они имеют соответствующие названия. Однако у них у всех один протон, что соответствует порядковому номеру водорода в периодической таблице. Изотоп водорода с одним нейтроном и массовым числом 2 называют дейтерием или тяжелым водородом, он стабилен. Тритий, изотоп водорода с массовым числом 3 и двумя нейтронами, радиоактивен. Его иногда называют сверхтяжелым водородом, а ядро трития — тритоном.
Источники:
- Радиация, Введение в радиационную защиту
Содержание
- Что такое изотопы в химии? Определение, строение
- Атом и его частицы
- Обозначения
- Нуклоны
- Изотопы водорода
- Тритий
- Изотопы урана
- Нуклиды
- Изотопы галлия
- Превращения изотопов
- Превращение изотопа радия
- Использование радиоактивных изотопов
- Урок 2. Изотопы элементов – HIMI4KA
- Что такое изотоп?
- Дефект массы и энергия связи ядра
- Что такое Изотопы
- Изотопы в Энциклопедическом словаре:
- Определение слова «Изотопы» по БСЭ:
- ИЗОТОПЫ
- Открытие изотопов, историческая справка
- Методы разделения изотопов
- Применение изотопов
Что такое изотопы в химии? Определение, строение
Ещё древние философы высказывали предположение, что материя строится из атомов. Однако о том, что сами «кирпичики» мироздания состоят из мельчайших частиц, учёные начали догадываться лишь на стыке XIX и XX веков. Опыты, доказывающие это, произвели в науке в своё время настоящую революцию.
Именно количественное соотношение составных частей отличает один химический элемент от другого. Каждому из них отведено своё место в Периодической системе Менделеева согласно порядковому номеру. Но существуют разновидности атомов, занимающие в таблице одни и те же клетки, несмотря на различие в массе и свойствах.
Почему это так и о том, что такое изотопы в химии, будет рассказано далее.
Атом и его частицы
Исследуя структуру материи посредством бомбардировки альфа-частицами, Э. Резерфорд доказал в 1910 году, что основное пространство атома заполнено пустотой. И только в центре находится ядро. Вокруг него по орбиталям двигаются отрицательные электроны, составляя оболочку этой системы. Так была создана планетарная модель «кирпичиков» материи.
Что такое изотопы? Вспомните из курса химии, что ядро тоже имеет сложное строение. Оно состоит из положительных протонов и не имеющих заряда нейтронов. Количество первых определяет качественные характеристики химического элемента. Именно число протонов отличает вещества друг от друга, наделяя их ядра определённым зарядом.
[attention type=yellow]
И по этому признаку им присваивается порядковый номер в таблице Менделеева. Но количество нейтронов у одного и того же химического элемента дифференцирует их на изотопы. Определение в химии данному понятию поэтому можно дать следующее.
[/attention]
Это разновидности атомов, отличающиеся по составу ядра, обладающие одинаковым зарядом и порядковым номеров, но имеющие разные массовые числа, ввиду различий в количестве нейтронов.
Обозначения
Изучая химию в 9 классе и изотопы, школьники узнают о принятых условных обозначениях. Буквой Z отмечается заряд ядра. Это цифра совпадает с количеством протонов и поэтому является их показателем. Сумма этих элементов с нейтронами, отмечаемыми значком N, составляет А – массовое число.
Семейство изотопов одного вещества, как правило, обозначается значком того химического элемента, которых в таблице Менделеева наделяется порядковым номером, совпадающим с числом протонов в нём. Левый верхний индекс, добавляемый к указанному значку соответствует массовому числу. К примеру, 238U.
Заряд элемента (в данном случае урана, отмеченного порядковым номером 92) обозначается похожим индексом снизу.
Зная эти данные, легко можно подсчитать количество нейтронов у данного изотопа. Оно равно массовому числу за вычетом порядкового номера: 238 – 92 = 146.
Количество нейтронов могло бы быть меньше, от этого данный химический элемент не перестал бы оставаться ураном.
Следует заметить, что чаще всего у других, более простых, веществ число протонов и нейтронов приблизительно совпадает. Подобные сведения помогают понять, что такое изотоп в химии.
Нуклоны
Индивидуальностью определённый элемент наделяет именно число протонов, а количество нейтронов на неё никаким образом не влияет.
Но атомная масса составляется из этих двух указанных элементов, имеющих общее наименование «нуклоны», представляя собой их сумму.
[attention type=red]
Однако этот показатель не зависит от числа электронов, формирующих отрицательно заряженную оболочку атома. Почему? Стоит только сравнить.
[/attention]
Доля массы протона в атоме велика и составляет приблизительно 1 а. е. м. или 1,672 621 898(21)·10-27кг. Нейтрон близок к показателям этой частицы (1,674 927 471(21)·10-27кг). А вот масса электрона в тысячи раз меньше, считается ничтожной и не учитывается. Вот почему, зная верхний индекс элемента в химии, состав ядра изотопов узнать несложно.
Изотопы водорода
Изотопы некоторых элементов настолько известны и распространены в природе, что получили собственные наименования. Ярким и наиболее простым примером тому может служить водород. В естественных условиях он содержится в своей самой распространённой разновидности протия. Этот элемент имеет массовое число 1, а ядро его состоит из одного протона.
Так что такое изотопы водорода в химии? Как известно, атомы этого вещества имеют первый номер в таблице Менделеева и соответственно наделены в природе зарядовым числом 1. Но количество нейтронов в ядре атома у них различно.
Дейтерий, являясь тяжёлым водородом, помимо протона имеет в составе ядра ещё одну частицу, то есть нейтрон.
В результате это вещество проявляет собственные физические свойства, в отличие от протия, обладая собственным весом, температурой плавления и кипения.
Тритий
Сложнее всех устроен тритий. Это сверхтяжёлый водород. В соответствии с определением изотопов в химии, он имеет зарядовое число 1, но массовое число 3.
Его часто называют тритоном, потому что помимо одного протона, он имеет в составе ядра два нейтрона, то есть состоит из трёх элементов.
Наименование этого элемента, открытого в 1934 году Резерфордом, Олифантом и Хартеком, было предложено ещё до его выявления.
Это неустойчивое вещество, проявляющее радиоактивные свойства. Ядро его обладает способностью расщепляться с выделение бета-частицы и электронного антинейтрино.
Энергия распада данного вещества не очень велика и составляет 18,59 кэВ. Поэтому подобная радиация не является для человека слишком опасной. От неё способна защитить обыкновенная одежда и хирургические перчатки.
А получаемый с пищей этот радиоактивный элемент быстро выводится из организма.
Изотопы урана
Гораздо опаснее оказываются различные типы урана, которых на сегодняшний день науке известно 26. Поэтому, рассказывая о том, что такое изотопы в химии, невозможно не упомянуть об этом элементе.
Несмотря на разнообразие видов урана, в природе его изотопов встречается всего три. К ним относятся 234U, 235U, 238U. Первый из них, обладая подходящими свойствами, активно применяется как топливо в ядерных реакторах.
А последний — для производства плутония-239, который сам, в свою очередь, незаменим как ценнейшее топливо.
[attention type=green]
Каждый из радиоактивных элементов характеризуется собственным периодом полураспада. Это отрезок времени, в течение которого вещество расщепляется в отношении ½.
[/attention]
То есть в результате этого процесса количество сохранившейся части вещества вдвое уменьшается. Этот отрезок времени для урана огромен.
К примеру, для изотопа-234 он исчисляется в 270 тысячелетий, а для двух других указанных разновидностей он гораздо значительнее. Рекордный период полураспада — у урана-238, продолжающийся миллиарды лет.
Нуклиды
Не каждый из видов атома, характеризующихся собственным и строго определённым числом протонов и электронов, настолько стабилен, чтобы существовать хоть сколько-нибудь продолжительный период, достаточный для его изучения. Те из них, которые обладают относительной устойчивостью, называются нуклидами.
Стабильные образования такого рода радиоактивному распаду не подвергаются. Нестабильные называются радионуклидами и тоже, в свою очередь, делятся на короткоживущие и долгожители. Как известно из уроков химии 11 класса о строении атомов изотопов, наибольшим числом радионуклидов обладают осмий и платина.
По одному стабильному имеют кобальт и золото, а наибольшее количество устойчивых нуклидов у олова.
Теперь постараемся обобщить сведения, описанные ранее. Поняв, что такое изотопы в химии, пришло время выяснить, как можно использовать полученные знания. Рассмотрим это на конкретном примере.
Допустим, известно, что некоторый химический элемент обладает массовым числом 181. При этом оболочка атома данного вещества содержит в себе 73 электрона.
Как можно, воспользовавшись таблицей Менделеева, узнать название данного элемента, а также число протонов и нейтронов в составе его ядра?
Приступим к решению задачи. Определить наименование вещества можно, зная его порядковый номер, который соответствует количеству протонов. Так как число положительных и отрицательных зарядов в атоме равны, то оно составляет 73. Значит, это тантал. При том, общее количество нуклонов в сумме составляет 181, а значит, протонов у данного элемента 181 – 73 = 108. Достаточно просто.
Изотопы галлия
Элемент галлий в периодической системе имеет порядковый номер 71. В природе у этого вещества есть два изотопа — 69Ga и 71Ga. Как определить процентное соотношение разновидностей галлия?
Решение задач на изотопы по химии почти всегда связано с информаций, которую можно получить из таблицы Менделеева. В этот раз следует поступить аналогичным образом. Определим из указанного источника среднюю атомную массу. Она равна 69,72.
Обозначив за x и y количественное соотношение первого и второго изотопа, примем сумму их равной 1. А значит, в виде уравнения это запишется: x + y = 1. Отсюда следует, что 69x + 71y = 69,72. Выразив y через x и подставив первое уравнение во второе, получаем, что x = 0,64, а y = 0,36.
Это значит, что 69Ga содержится в природе 64 %, а процентное соотношение 71Ga составляет 34 %.
Превращения изотопов
Радиоактивное расщепление изотопов с трансформацией их в другие элементы разделяется на три основных типа. Первым из них является альфа-распад. Он происходит с испусканием частицы, представляющей собой ядро атома гелия. То есть это образование, состоящие из совокупности пар нейтронов и протонов.
Поскольку количество последних определяет зарядовое число и номер атома вещества в периодической системе, то в результате этого процесса происходит качественное превращение одного элемента в другой, а в таблице он сдвигается влево на две клетки. При этом массовое число элемента уменьшается на 4 единицы.
Это мы знаем из разделов химии о строении атомов изотопов.
При потере ядром атома бета-частицы, по сути представляющей собой электрон, меняется его состав. Один из нейтронов трансформируется в протон. Это значит, что качественные характеристики вещества вновь меняются, а элемент сдвигается в таблице на одну клетку вправо, практически не теряя при этом в массе. Обычно подобное превращение сопряжено с электромагнитным гамма-излучением.
Превращение изотопа радия
Вышеизложенные сведения и знания из химии 11 класса об изотопах снова помогают решать практические задачи. К примеру, следующие: 226Ra при распаде превращается в химический элемент IV группы, обладающий массовым числом 206. Сколько альфа- и бета-частиц при этом он должен потерять?
Учитывая изменения в массе и группу дочернего элемента, воспользовавшись таблицей Менделеева, легко определить, что образовавшимся при расщеплении изотопом будет свинец с зарядом 82 и массовым числом 206. А учитывая зарядовое число этого элемента и исходного радия, следует предположить, что ядро его потеряло пять альфа-частиц и четыре бета-частицы.
Использование радиоактивных изотопов
Всем прекрасно известно, какой вред живым организмам может нанести радиоактивное излучение. Однако свойства радиоактивных изотопов бывают для человека полезны.
Они с успехом применяются во многих отраслях промышленности.
С их помощью возможно обнаружить утечку в инженерных и строительных сооружениях, подземных трубопроводах и нефтепроводах, накопительных баках, теплообменниках на электростанциях.
Указанные свойства активно используются также в научных экспериментах. К примеру, муха цеце является переносчиком многих серьёзных заболеваний для человека, скота и домашних животных.
[attention type=yellow]
В целях предотвращения подобного самцов этих насекомых стерилизуют посредством слабого радиоактивного излучения.
[/attention]
Изотопы также бывают незаменимы при изучении механизмов некоторых химических реакций, ведь атомами данных элементов можно метить воду и другие вещества.
При биологических исследованиях часто также используются меченые изотопы. К примеру, именно таким образом было установлено, как фосфор влияет на почву, рост и развитие культурных растений. С успехом свойства изотопов применяются и в медицине, что позволило лечить раковые опухоли и другие тяжёлые заболевания, определять возраст биологических организмов.
Урок 2. Изотопы элементов – HIMI4KA
Архив уроков › Основные законы химии
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами.
Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает.
По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число.
Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона.
Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3).
Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены.
Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию.
Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс.
Формула для расчета дефекта массы ядра:
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы).
[attention type=red]
Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.
[/attention]
) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе.
Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg.
Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg.
Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Что такое Изотопы
Изотопы — Разновидности одного и того же химического элемента, отличающиеся атомной массой.
Изотопы в Энциклопедическом словаре:
Изотопы — (от изо… и греч. topos — место) — разновидности химическихэлементов, у которых ядра атомов отличаются числом нейтронов, но содержатодинаковое число протонов и поэтому занимают одно и то же место впериодической системе элементов. Различают устойчивые (стабильные) изотопыи радиоактивные изотопы. Термин предложен Ф. Содди в 1910.
Определение слова «Изотопы» по БСЭ:
Изотопы (от изо… и греч. tуpos — место)
разновидности одного химического элемента, занимающие одно место в периодической системе элементов Менделеева, но отличающиеся массами атомов. Химические свойства атомов, т. е. принадлежность атома к тому или иному химическому элементу, зависят от числа электронов и их расположения в электронной оболочке атома (см.
Атом). Место химического элемента в периодической системе элементов определяется его порядковым номером Z, равным числу электронов в оболочке атома или, что то же самое, числу Протонов, содержащихся в атомном ядре. Кроме протонов, в ядро атома входят Нейтроны, масса каждого из которых приблизительно равна массе протона.
Количество нейтронов N в ядре атома с данным Z может быть различным, но в определённых пределах.
Например, в ядре атома гелия (Z = 2) может содержаться 1, 2, 4 или 6 нейтронов. Полное число протонов Z и нейтронов N в ядре (называется общим термином нуклоны) определяет массу ядра и по существу массу всего атома. Это число A = Z + N называется массовым числом атома.
От соотношения чисел протонов и нейтронов в ядре зависят стабильность или нестабильность ядра, тип распада радиоактивного ядра, Спин, магнитный дипольный момент, электрический квадрупольный момент ядра (См. Квалрупольный момент ядра) и некоторые другие его свойства (см. Ядро атомное).
Таким образом, атомы с одинаковым Z, но с различным числом нейтронов N обладают идентичными химическими свойствами, но имеют различные массы и различные ядерные свойства. Эти разновидности атомов также называются И. Для обозначения любых разновидностей атомов, независимо от их принадлежности к одному элементу, применяют термин нуклиды.
Массовое число И.
приводится сверху слева от химического символа элемента. Например, И. гелия обозначаются: іHe, 4He, 6He, 8He. Более развёрнутые обозначения: 12Неі, 22He4, 42Не6, 62He8, где нижний индекс указывает число протонов Z, верхний левый индекс — число нейтронов N, а верхний правый — массовое число. При обозначении И.
без применения символа элемента массовое число A даётся после наименования элемента: гелий-3, гелий-4 и т. п.
Массы атомов М, выраженные в атомных единицах массы, лишь немного отличаются от целых чисел. Поэтому разность М — А всегда правильная дробь, по абсолютной величине меньше Ѕ, и таким образом массовое число A есть ближайшее к массе атома М целое число.
Знание массы атома определяет полную энергию E связи всех нуклонов в ядре. Эта энергия выражается соотношением E = &Delta.McІ, где c — скорость света в вакууме, &Delta.М — разность между суммарной массой всех входящих в ядро нуклонов в свободном состоянии и массой ядра, которая равна массе нейтрального атома без массы всех электронов.
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов.
[attention type=green]
В 1906-07 выяснилось, что продукт радиоактивного распада Урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, однако отличаются от последнего атомной массой и характеристиками радиоактивного распада. Более того, как было обнаружено позднее, все три элемента имеют одинаковые оптические и рентгеновские спектры.
[/attention]
Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Ф. Содди, стали называть И.
После того как И. были обнаружены у тяжёлых радиоактивных элементов, начались поиски И. у стабильных элементов. В 1913 английский физик Дж. Томсон обнаружил И. у неона.
Разработанный им метод парабол позволял определить отношение массы иона к его заряду по отклонению в параллельно направленных электрическом и магнитном полях тонкого пучка положительных ионов, получаемых в высоковольтном электрическом разряде (см. Масс-спектрометры). Наряду с атомами 20Ne Томсон наблюдал небольшую примесь более тяжёлых атомов.
Однако убедительных доказательств того, что вторая компонента более тяжёлых атомов является И. неона, получено не было. Лишь с помощью первого масс-спектрографа, построенного в 1919 английским физиком Ф. Астоном, были получены надёжные доказательства существования двух И. 20Ne и 22Ne, относительное содержание (распространённость) которых в природе составляет приблизительно 91% и 9%.
В дальнейшем был обнаружен изотоп 21Ne с распространённостью 0,26%, И. хлора, ртути и ряда других элементов. Примерно к 1940 изотопный анализ был осуществлен для всех существующих на Земле элементов. В результате этого были выявлены и идентифицированы практически все стабильные и долгоживущие радиоактивные И. природных элементов.
В 1934 И. Кюри и Ф.
Жолио получили искусственным путём радиоактивные И. азота (13N), кремния (28Si) и фосфора (30P), отсутствующие в природе. Этими экспериментами они продемонстрировали возможность синтеза новых радиоактивных нуклидов. В последующие годы с помощью ядерных реакций под действием нейтронов и ускоренных заряженных частиц было синтезировано большое число радиоактивных И.
известных элементов, а также получено около 20 новых элементов. Известно 276 стабильных И., принадлежащих 81 природному элементу, и около 1500 радиоактивных И. 105 природных и синтезированных элементов.
Анализ соотношений между числами нейтронов и протонов для различных И. одного и того же элемента показывает, что ядра стабильных И. и радиоактивных И.
, устойчивых по отношению к бета-распаду, содержат на каждый протон не менее одного нейтрона. Исключение из этого правила составляют лишь два нуклида — 1H и іHe. По мере перехода ко всё более тяжёлым ядрам отношение числа нейтронов к числу протонов в ядре растет и достигает 1,6 для урана и трансурановых элементов.
Элементы с нечётным Z имеют не более двух стабильных И.
Как правило, число нейтронов N в таких ядрах чётное, и, следовательно, массовое число A — нечётное. Большинство элементов с чётным Z имеет несколько стабильных И., из которых не более двух с нечётным A. Наибольшее число И. (10) имеет олово, 9 И. — у ксенона, 8 — у кадмия и теллура. Многие элементы имеют 7 И.
Такие широкие вариации в числе стабильных И.
[attention type=yellow]
у различных элементов обусловлены сложной зависимостью энергии связи ядра от числа протонов и нейтронов в ядре. По мере изменения числа нейтронов N в ядре с данным числом протонов Z энергия связи ядра и его устойчивость по отношению к различным типам распада меняются.
[/attention]
При добавлении нейтронов ядро становится неустойчивым по отношению к испусканию электрона с превращением одного нейтрона в ядре в протон (см. Ядро атомное). Поэтому нейтронообогащённые И. всех элементов &beta.&minus. -активны (см. Бета-распад). Наоборот, при обеднении нейтронами ядро получает возможность или захватить электрон из оболочки атома, или испустить Позитрон.
При этом один протон превращается в нейтрон и оптимальное соотношение между числом протонов и нейтронов в ядре восстанавливается.
Нейтронообеднённые И. всех элементов испытывают или электронный захват или позитронный распад. У тяжёлых ядер наблюдаются также Альфа-распад и самопроизвольное (спонтанное) деление ядер. Получение нейтроноизбыточных И.
элементов возможно несколькими способами. Один из них — реакция захвата нейтронов ядрами стабильных И. Другой — деление тяжёлых ядер под действием нейтронов или заряженных частиц, в результате которого из одного тяжёлого ядра с большим относительным содержанием нейтронов образуются два нейтронообогащённых ядра. Нейтронообогащённые И.
лёгких элементов эффективно образуются в реакциях многонуклонного обмена при взаимодействии ускоренных тяжёлых ионов с веществом. Синтез нейтроно-дефицитных И. осуществляется в ядерных реакциях под действием ускоренных заряженных лёгких частиц или тяжёлых ионов.
Все стабильные И.
на Земле возникли в результате ядерных процессов, протекавших в отдалённые времена, и их распространённость зависит от свойств ядер и от первоначальных условий, в которых происходили эти процессы. Изотопный состав природных элементов на Земле, как правило, постоянен.
Это объясняется тем, что он не подвергается значительным изменениям в химических и физических процессах, протекающих на Земле. Однако небольшие колебания в относительной распространённости И. всё же наблюдаются для лёгких элементов, у которых различие в массах атомов И. относительно велико. Эти колебания обусловлены изменением изотопного состава элементов (фракционированием И.
), происходящим в результате диффузии, изменения агрегатного состояния вещества, при некоторых химических реакциях и других процессах, непрерывно протекающих в атмосфере и земной коре (см. Изотопов разделение, Изотопные методы в геологии, Изотопный обмен).
Изменение изотопного состава элементов, интенсивно мигрирующих в биосфере (Н, С, N, О, S), связано и с деятельностью живых организмов.
Для нуклидов, образующихся в результате радиоактивного распада, например для И. свинца, различное содержание И.
[attention type=red]
в разных образцах обусловлено разным первоначальным содержанием их родоначальников (U или Th) и разным геологическим возрастом образцов (см. Геохронология, Масс-спектроскопия, Радиоактивность).
Единство образования тел Солнечной системы позволяет думать, что изотопный состав элементов земных образцов характерен для всей Солнечной системы в целом (при наличии известных колебаний). Метеоры и глубокие слои земной коры показывают примерно одинаковое отношение 16O/18O. Астрофизические исследования обнаруживают отклонения изотопного состава элементов, составляющих звёздное вещество и межзвёздную среду, от земного. Например, для углеродных R-звёзд отношение 12C/13C изменяется от 4-5 до земного значения.
Возможность примешивать к природным химическим элементам их радиоактивные И. позволяет следить за различными химическими и физическими процессами, в которых участвует данный элемент, с помощью детекторов радиоактивных излучений. Этот метод получил широкое применение в биологии, химии, медицине, а также в технике. Иногда примешивают стабильные И., присутствие которых обнаруживают в дальнейшем масс-спектральными методами (см. Изотопные индикаторы).
Важной проблемой является выделение отдельных И. из их природной или искусственно полученной смеси или обогащение этой смеси каким-либо И.
Лит.: Астон Ф. В., Масс-спектры и изотопы, пер. с англ., М., 1948. Кравцов В. А., Массы атомов и энергии связи ядер, М., 1965. Lederer С. М., Hollander J. М., Periman I., Table of isotopes, 6 ed., N. Y. — [a. o.], 1967.
Н. И. Тарантин.
[/attention]
ИЗОТОПЫ
статьи
ИЗОТОПЫ –разновидности одного и того же химического элемента, близкие по своим физико-химическим свойствам, но имеющие разную атомную массу.
Название «изотопы» было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал его из двух греческих слов: isos – одинаковый и topos – место.
Изотопы занимают одно и то же место в клетке периодической системы элементов Менделеева.
Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его облака отрицательно заряженных электронов. Положение химического элемента в периодической системе Менделеева (его порядковый номер) определяется зарядом ядра его атомов.
Изотопами называются поэтому разновидности одного и того же химического элемента, атомы которых имеют одинаковый заряд ядра (и, следовательно, практически одинаковые электронные оболочки), но отличаются значениями массы ядра. По образному выражению Ф.
Содди, атомы изотопов одинаковы «снаружи», но различны «внутри».
В 1932 был открыт нейтрон – частица, не имеющая заряда, с массой, близкой к массе ядра атома водорода – протона, и создана протонно-нейтронная модель ядра.
В результате в науке установилось окончательное современное определение понятия изотопов: изотопы – это вещества, ядра атомов которых состоят из одинакового числа протонов и отличаются лишь числом нейтронов в ядре.
Каждый изотоп принято обозначать набором символов , где X – символ химического элемента, Z – заряд ядра атома (число протонов), А – массовое число изотопа (общее число нуклонов – протонов и нейтронов в ядре, A = Z + N). Поскольку заряд ядра оказывается однозначно связанным с символом химического элемента, часто для сокращения используется просто обозначение AX.
Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2H и 3H носят названия дейтерия и трития и получили обозначения соответственно D и T (изотоп 1H называют иногда протием).
В природе встречаются как стабильные изотопы, так и нестабильные – радиоактивные, ядра атомов которых подвержены самопроизвольному превращению в другие ядра с испусканием различных частиц (или процессам так называемого радиоактивного распада).
Сейчас известно около 270 стабильных изотопов, причем стабильные изотопы встречаются только у элементов с атомным номером Z Ј 83. Число нестабильных изотопов превышает 2000, подавляющее большинство их получено искусственным путем в результате осуществления различных ядерных реакций.
[attention type=green]
Число радиоактивных изотопов у многих элементов очень велико и может превышать два десятка. Число стабильных изотопов существенно меньше, Некоторые химические элементы состоят лишь из одного стабильного изотопа (бериллий, фтор, натрий, алюминий, фосфор, марганец, золото и ряд других элементов).
[/attention]
Наибольшее число стабильных изотопов – 10 обнаружено у олова, у железа, например, их – 4, у ртути – 7.
Открытие изотопов, историческая справка
В 1808 английский ученый натуралист Джон Дальтон впервые ввел определение химического элемента как вещества, состоящего из атомов одного вида. В 1869 химиком Д.И.Менделеевым была открыт периодический закон химических элементов.
Одна из трудностей в обосновании понятия элемента как вещества, занимающего определенное место в клетке периодической системы, заключалась в наблюдаемой на опыте нецелочисленности атомных весов элементов.
В 1866 английский физик и химик – сэр Вильям Крукс выдвинул гипотезу, что каждый природный химический элемент представляет собой некоторую смесь веществ, одинаковых по своим свойствам, но имеющих разные атомные масс, однако в то время такое предположение не имело еще экспериментального подтверждения и поэтому прошло мало замеченным.
Важным шагом на пути к открытию изотопов стало обнаружение явления радиоактивности и сформулированная Эрнстом Резерфордом и Фредериком Содди гипотеза радиоактивного распада:радиоактивность есть не что иное, как распад атома на заряженную частицу и атом другого элемента, по своим химическим свойствам отличающийся от исходного.
В результате возникло представление о радиоактивных рядах или радиоактивных семействах, в начале которых есть первый материнский элемент, являющийся радиоактивным, и в конце – последний стабильный элемент. Анализ цепочек превращений показал, что в их ходе в одной клеточке периодической системы могут оказываться одни и те же радиоактивные элементы, отличающиеся лишь атомными массами.
Фактически это и означало введение понятия изотопов.
Независимое подтверждение существования стабильных изотопов химических элементов было затем получено в экспериментах Дж. Дж. Томсона и Астона в 1912–1920 с пучками положительно заряженных частиц (или так называемых каналовых лучей), выходящих из разрядной трубки.
В 1919 Астон сконструировал прибор, названный масс-спектрографом (или масс-спектрометром).
В качестве источника ионов по-прежнему использовалась разрядная трубка, однако Астон нашел способ, при котором последовательное отклонение пучка частиц в электрическом и магнитном полях приводило к фокусировке частиц с одинаковым значением отношения заряда к массе (независимо от их скорости) в одной и той же точке на экране.
Наряду с Астоном масс-спектрометр несколько другой конструкции в те же годы был создан американцем Демпстером. В результате последующего использования и усовершенствования масс-спектрометров усилиями многих исследователей к 1935 году была составлена почти полная таблица изотопных составов всех известных к тому времени химических элементов.
Методы разделения изотопов
Для изучения свойств изотопов и особенно для их применения в научных и прикладных целях требуется их получение в более или менее заметных количествах. В обычных масс-спектрометрах достигается практически полное разделение изотопов, однако количество их ничтожно мало.
Поэтому усилия ученых и инженеров были направлены на поиски других возможных методов разделения изотопов.
В первую очередь были освоены физико-химические методы разделения, основанные на различиях в таких свойствах изотопов одного итого же элемента, как скорости испарения, константы равновесия, скорости химических реакций и т.п.
[attention type=yellow]
Наиболее эффективными среди них оказались методы ректификации и изотопного обмена, которые нашли широкое применение в промышленном производстве изотопов легких элементов: водорода, лития, бора, углерода, кислорода и азота.
[/attention]
Другую группу методов образуют так называемые молекулярно-кинетические методы: газовая диффузия, термодиффузия, масс-диффузия (диффузия в потоке пара), центрифугирование.
Методы газовой диффузии, основанные на различной скорости диффузии изотопных компонентов в высокодисперсных пористых средах, были использованы в годы второй мировой войны при организации промышленного производства разделения изотопов урана в США в рамках так называемого Манхэттенского проекта по созданию атомной бомбы.
Для получения необходимых количеств урана, обогащенного до 90% легким изотопом 235U – главной «горючей» составляющей атомной бомбы, были построены заводы, занимавшие площади около четырех тысяч гектар. На создание атомного центра с заводами для получения обогащенного урана было ассигновано более 2-х млрд. долл.
После войны в СССР были разработать и построены заводы по производству обогащенного урана для военных целей, также основанные на диффузионном методе разделения. В последние годы этот метод уступил место более эффективному и менее затратному методу центрифугирования.
В этом методе эффект разделения изотопной смеси достигается за счет различного действия центробежных сил на компоненты изотопной смеси, заполняющей ротор центрифуги, который представляет собой тонкостенный и ограниченный сверху и снизу цилиндр, вращающийся с очень высокой скоростью в вакуумной камере.
Сотни тысяч соединенных в каскады центрифуг, ротор каждой из которых совершает более тысячи оборотов в секунду, используются в настоящее время на современных разделительных производствах как в России, так и в других развитых странах мира.
Центрифуги используются не только для получения обогащенного урана, необходимого для обеспечения работы ядерных реакторов атомных электростанций, но и для производства изотопов примерно тридцати химических элементов средней части периодической системы. Для разделения различных изотопов используются также установки электромагнитного разделения с мощными источниками ионов, в последние годы получили распространение также лазерные методы разделения.
Применение изотопов
Разнообразные изотопы химических элементов находят широкое применение в научных исследованиях, в различных областях промышленности и сельского хозяйства, в ядерной энергетике, современной биологии и медицине, в исследованиях окружающей среды и других областях.
В научных исследованиях (например, в химическом анализе) требуются, как правило, небольшие количества редких изотопов различных элементов, исчисляемые граммами и даже миллиграммами в год. Вместе с тем, для ряда изотопов, широко используемых в ядерной энергетике, медицине и других отраслях, потребность в их производстве может составлять многие килограммы и даже тонны.
[attention type=red]
Так, в связи с использованием тяжелой воды D2O в ядерных реакторах ее общемировое производство к началу 1990-х прошлого века составляло около 5000 т в год.
[/attention]
Входящий в состав тяжелой воды изотоп водорода дейтерий, концентрация которого в природной смеси водорода составляет всего 0,015%, наряду с тритием станет в будущем, по мнению ученых, основным компонентом топлива энергетических термоядерных реакторов, работающих на основе реакций ядерного синтеза. В этом случае потребность в производстве изотопов водорода окажется огромной.
В научных исследованиях стабильные и радиоактивные изотопы широко применяются в качестве изотопных индикаторов (меток) при изучении самых различных процессов, происходящих в природе.
В сельском хозяйстве изотопы («меченые» атомы) применяются, например, для изучения процессов фотосинтеза, усвояемости удобрений и для определения эффективности использования растениями азота, фосфора, калия, микроэлементов и др. веществ.
Изотопные технологии находят широкое применение в медицине. Так в США, согласно статистическим данным, проводится более 36 тыс. медицинских процедур в день и около 100 млн. лабораторных тестов с использованием изотопов. Наиболее распространены процедуры, связанные с компьютерной томографией.
Изотоп углерода C13, обогащенный до 99% (природное содержание около 1%), активно используется в так называемом «диагностическом контроле дыхания». Суть теста очень проста.
Обогащенный изотоп вводится в пищу пациента и после участия в процессе обмена веществ в различных органах тела выделяется в виде выдыхаемого пациентом углекислого газа СО2, который собирается и анализируется с помощью спектрометра.
Различие в скоростях процессов, связанных с выделением различных количеств углекислого газа, помеченных изотопом С13, позволяют судить о состоянии различных органов пациента. В США число пациентов, которые будут проходить этот тест, оценивается в 5 млн. человек в год. Сейчас для производства высоко обогащенного изотопа С13 в промышленных масштабах используются лазерные методы разделения.
Владимир Жданов
8 класс УРОК № 6
Тема: Состав атомных
ядер.
Цель: рассмотреть физический смысл порядкового
номера элемента, научить обучающихся описывать состав атомных ядер, разъяснить
понятие изотопов, явление радиоактивности.
Задачи:
Обучающие:
- Научить обучающихся определять состав
атома (количество протонов, электронов и нейтронов) состав изотопов
химических элементов; - сформировать понятие об нуклидах и
изотопах; - сформировать понятие об изотопах водорода;
- сформировать понятие об относительной
атомной массе как средней массе природных изотопов элементов.
Развивающие:
—
Отработать
навыки определения состава атома, состава ядра атома по периодической системе
химических элементов;
—
развитие
навыков работы с опорным конспектом, таблицами и схемами.
—
развивать
у учащихся навыки наблюдения, логического мышления, умения обобщать, делать выводы,
проводить самопроверку.
Воспитательные:
—
Воспитывать
умение работать самостоятельно и в группе, в атмосфере поиска, прививать
чувство ответственности за выполненную работу.
Оборудование:
1. Периодическая
система химических элементов Д.И. Менделеева, печатный дидактический материал.
Тип урока:
комбинированный.
I.
Начало урока:
1. Организационные
моменты (1 мин)
2. Проверка
домашнего задания. (на наличие в тетради выполненного ДЗ) (2 мин)
3. Актуализация опорных знаний (7 мин.):
Провести беседу по
изученному материалу на прошлом уроке:
1. В чем суть опыта Резерфорда? (Опыт
Резерфорда: В 1911 году английский физик Эрнест Резерфорд проводил
опыты с α –лучами. Он направил поток α –частиц на очень тонкую золотую фольгу,
за которой поместил экран. Было установлено, что большая часть α –частиц
проходила через фольгу, не изменяя своего направления движения, т.е. не
встречая на своем пути препятствий. Но небольшая доля α –частиц отклонялась от
прямолинейного пути на различные углы. Самым интересным оказалось то, что
приблизительно одна из 10000 α –частиц отскакивала от металлической фольги
обратно почти под углом 180°).
2. Из каких частиц состоит атом?
(Протонов, нейтронов и электронов)
3. Сформулируйте
основные положения планетарной модели строения
атома.
1.
В центре атома находится положительно
заряженное ядро, занимающее незначительную часть пространства внутри атома
(рис. 1):
2.
Весь положительный заряд и масса атома
сосредоточены в его ядре.
3.
Ядро состоит из протонов и нейронов. Число
протонов равно порядковому номеру элемента, а сумма чисел протонов и нейронов
соответствует его массовому числу.
4.
Вокруг ядра вращаются электроны. Их число равно
положительному заряду ядра.
5.
Различные виды атомов называются нуклидами. Они
характеризуются массовым числом (А), зарядом ядра (Z),
числом нейронов (N). Причем A
= Z
+ N.
Нуклиды с одинаковым зарядом ядра, но разными массовым число и числом нейронов,
называются изотопами.
II. Основная
часть (работа по теме урока) (35 мин.)
1. Сообщение темы
урока и постановка целей урока.
2. Изучение нового
материала:
2.1 «Состав атомных ядер : электроны, нуклоны – протоны и
нейроны. Заряд ядра. Массовое число.»
|
Он бежит по проводам, Он бывает тут и там. Свет зажег, нагрел утюг Электрон — наш лучший друг. Если в атом он попал – То, считай, почти пропал: Он с утра и до утра Носится вокруг ядра. |
Очень положительный, С массою внушительной. А таких, как он, отряд Создаёт в ядре заряд. Лучший друг его — нейтрон. Догадались? Он — протон! |
Зарядом похвастаться я не могу, А потому сижу в ядре и ни гу-гу. А то подумают: шпион… А я нейтральный, и зовусь нейтрон! |
Атомы
состоят из положительно заряженного ядра и электронов.
Ядро
атома состоит из протонов и нейронов. Протоны и нейроны объединяют одним
названием – нуклоны («нуклеос» по – гречески «ядро»).
Протоны представляют собой положительно заряженные частицы с условным зарядом
«+1», нейроны заряда не имеют.
Нуклон – это разновидность атомов с
определенным числом протонов и нейронов в ядре.
Каждый
нуклон характеризуют определенными числами.
Протонное число Z – указывает
число протонов в ядре атома данного нуклона. Нейтронное число N
– указывает число нейтронов в ядре данного нуклона. Массовое
число А – это сумма протонного и нейронного чисел :
Поскольку
масса каждого протона и нейтрона равна приблизительно 1 а.е.м., а электрона –
мизерна, то массовое число каждого атома приблизительно равняется его относительной
атомной массе.
В
химии используют специальные обозначения нуклонов: заряд ядра, т.е. протонное
число, пишут слева внизу от символа химического элемента, а массовое число –
слева вверху, например, для нуклона кислорода : .
В
соответствии с законом Г. Мозли (1913), заряд ядра численно равен порядковому
номеру элемента в Периодической системе Д.И. Менделеева. Другими словами :
|
Порядковый номер |
Заряд ядра |
Число В |
Число |
Задача 1. Сколько протонов,
нейронов и электронов содержится в нуклиде свинца – 210.
Решение:
Массовое
число данного нуклида свинца равняется 210. Поскольку свинец имеет порядковый
номер 82, то в атоме нуклида свинца-210 содержится 82 протона и 82 электрона.
Число нейтронов вычислим как разницу между массовым числом и числом протонов: N
= 210 – 82 = 128.
Ответ: 82 протона, 128 нейтронов, 82
электрона.
2.2 «Изотопы : стабильные и радиоактивные. Изотопы
водорода.»
Изотопами называются нуклиды,
которые имеют одинаковый заряд (протонное число) и разное нейтронное число.
Обычно
изотопы химических элементов не имеют собственных названий, единственным
исключением является водород. Его изотопы обозначают специальными символами и называют
по – разному:
·
Обычный водород Н () –
протий, ядра его атомов состоят только из одного протона.
·
Тяжелый водород D () –
дейтерий, в ядрах его атомов, кроме одного протона, содержится еще один
нейтрон.
·
Сверхтяжелый водород Т () –
тритий, в ядрах его атомов, кроме одного протона, содержится еще два нейтрона.
В
природе каждый элемент существует в виде смеси нескольких изотопов, например:
·
углерод имеет три изотопа (12С, 13С,
14С),
·
азот имеет два изотопа (14N,
15N),
·
кислород имеет три изотопа (16О, 17О,
18О).
В
тоже время некоторые химические элементы имеют лишь один природный изотоп,
например, фтор (19F), натрий (23Na),
алюминий (27Al), фосфор (31Р).
Все
изотопы разделяются на стабильные и нестабильные. Стабильные изотопы существуют
бесконечно долгое время. Преобладающее число атомов, которые нас окружают,
принадлежат к стабильным изотопам. Нестабильные изотопы подвергаются
радиоактивному распаду и образуют атомы других элементов. Например, изотоп
урана-238 способен испускать ядро атома гелия и при этом он превращается в атом
тория-234:
→
Химические
элементы, которые не имеют стабильных изотопов, называют радиоактивными. К их
числу входят все элементы, которые расположены в Периодической системе за
висмутом. Большинство радиоактивных элементов получены искусственно и в природе
не встречаются.
2.3 «Относительная атомная масса элемента как средняя масса
природных изотопов элементов»
Значение
относительных атомных масс элементов, приведенные в периодической таблице, не
являются целыми: Ar(C)
= 12,011, Ar(Cl) =
35,453, в то время как массовые числа всех нуклидов являются целыми числами.
Это связано с тем, что большинство элементов встречается в природе в виде
нескольких изотопов, и значение, приведенное в таблице, является средним,
рассчитанным с учетом процентного содержания каждого изотопа в земной коре.
Так, природный хлор приблизительно на 75% состоит из атомов 35Сl
и на 25% с 37Сl, поэтому его атомная масса
равняется 35,5:
Ar(Cl)
= (w(35Cl)*A(35Cl) + w(37Cl)*A(37Cl))/100
= 0,75*35 + 0,25*37 = 35,5.
2.4 «Понятие о радиоактивности»
Слушаем доклады обучающихся «Об открытии радиоактивности» и
«Научный путь Марии Складовской Кюри».
В 1895 г. В. Рентген обнаружил лучи, которые возникали при
пропускании тока высокого напряжения через стеклянный баллон с разреженным
воздухом. Эти лучи обладали способностью вызывать почернение фотопластинки в
светонепроницаемой упаковке. В 1896 г. А. Беккерель обнаружил, что соединения
урана и некоторые его природные руды (соли урана) самопроизвольно излучают
невидимые лучи, обладающие большой проникающей способностью и вызывающие
почернение фотопластинки. В 1898 г. Мария Склодовская-Кюри и Пьер Кюри
установили, что излучать лучи могут не только уран и его соединения, но и
некоторые другие элементы: радий, торий, полоний. Явление самопроизвольного
излучения было названо радиоактивностью, а вещества, излучающие лучи,
радиоактивными. В дальнейшем было установлено, что эти излучения связаны с
процессом самопроизвольного распада ядер атомов этих веществ. Оказалось, что
радиоактивное излучение состоит из трех компонентов разной природы. В магнитном
поле эти излучения делятся на три пучка:
·
лучи,
заряженные отрицательно, β-лучи – отклоняются в сторону севера;
·
лучи,
заряженные положительно, α-лучи – отклоняются в сторону юга;
·
лучи,
не имеющие электрического заряда (нейтральные), γ-лучи – не отклоняются.
Радиоактивность (по современным
взглядам) – это свойство ядер определенных элементов самопроизвольно (т.е. без
каких-либо внешних воздействий) превращаться в ядра других элементов с
испусканием особого рода излучений, которые называют радиоактивными
излучениями. Само явление называется радиоактивным распадом.
Радиоактивные превращения, в отличие от химических реакций,
происходят самопроизвольно и непрерывно, всегда сопровождаются выделением
энергии. На их скорость не оказывает никакого влияния ни изменение температуры
и давления, ни самый лучший химический катализатор, ни электрическое и
магнитное поля, ни агрегатное состояние вещества. Их нельзя ни ускорить, ни
замедлить.
Радиоактивность, наблюдающаяся в ядрах, существующих в
природных условиях, называют естественной радиоактивностью. Аналогичные
процессы, происходящие в искусственно полученных веществах, называют искусственной
радиоактивностью. Между – искусственной и естественной радиоактивностью
нет принципиального различия. Процесс радиоактивного превращения в обоих
случаях подчиняется одним и тем же законам (закон сохранения энергии,
электрических зарядов и др.). По закону сохранения количества нуклонов, число
нуклонов при любом радиоактивном распаде сохраняется, причем нуклоны одного
вида могут превращаться в нуклоны другого вида (нейтроны в протоны и наоборот).
Изотопы, обладающие радиоактивностью, называют
радиоактивными изотопами. Как уже отмечалось, ядра всех изотопов химических
элементов называют нуклидами (т.е. радионуклиды – это радиоактивные атомы с
данным массовым числом и атомным номером). Вещества, содержащие в своем составе
радионуклиды, называются радиоактивными веществами. Элементы, состоящие только
из радиоактивных изотопов, называются радиоактивными элементами.
3. Закрепление
изученного материала :
1. Как определить количество электронов, протонов, нейтронов
и заряд ядра в атоме?
2. Определите количество электронов, протонов, нейтронов,
заряд ядра для атомов лития, углерода, фтора, магния, серы, титана, никеля,
цинка, олова.
III. Заключительная часть: (2
мин.)
1. Домашнее
задание (Прочитать §52 стр. 181-184. Выучить конспект. Решить задачи №8 и 17 из
дидактического материала).
2. Подведение
итогов. Выставление оценок.
Вопросы, упражнения и задачи
1.
Сформулируйте определения: элементарная частица, атом, ион, молекула, ядро,
протон, нейтрон, электрон.
2.
Перечислите элементарные частицы. Какими символами они обозначаются? Каковы
заряды элементарных частиц?
3.
Как определить количество электронов, протонов, нейтронов и заряд ядра в атоме?
4.
Определите количество электронов, протонов, нейтронов, заряд ядра для атомов
лития, углерода, фтора, магния, серы, титана, никеля, цинка, олова.
5.
Вставь пропущенные слова:
а)
в состав ядра входят … и … ;
б)
общее число протонов в ядре равно … ядра и … элемента;
в)
заряд протона равен … ;
г)
масса протона равна … ;
д)
общее число нейтронов в ядре равно … ;
е)
заряд нейтрона равен … ;
ж)
масса нейтрона равна … .
6.
Назовите элементы с зарядом ядра +2, +5, +19, +15. Охарактеризуйте их положение
в ПС.
7.
Назовите элементы с общим числом электронов 10, 14, 26, 34 и охарактеризуйте их
положение в ПС.
8.
Заполните пропуски в таблице:
|
Символ элемента |
Название |
№ периода |
№ группы |
Кол-во электронов |
Кол-во протонов |
Кол-во нейтронов |
Заряд ядра |
|
Si |
|||||||
|
Барий |
|||||||
|
3 |
5 |
||||||
|
24 |
|||||||
|
35 |
|||||||
|
51 |
71 |
||||||
|
+29 |
9.
Определите заряд частицы, если она содержит: а) ядро с зарядом +26 и 26
электронов; б) ядро с зарядом +8 и 10 электронов; в) ядро с зарядом +11 и 10
электронов; г) ядро с зарядом + 6 и 6 электронов; д) ядро с зарядом +9 и 10
электронов; е) ядро с зарядом +12 и 10 электронов.
10.
Заполните таблицу
|
Элемент |
Нуклонное |
Протонное |
Количество |
||
|
протонов |
электронов |
нейтронов |
|||
|
Li |
6 |
||||
|
O |
16 |
||||
|
Mg |
25 |
||||
|
Ar |
40 |
||||
|
Ti |
49 |
11.
Сколько протонов и электронов содержится в ионах S2−, Н+,
Аl3+, F⎺, Са2+?
12.
Сколько протонов и электронов содержится в ионах Н⎺,
Сl⎺, Na+, Ті4+, Mg2+?
13.
Приведите полное обозначение нуклида, который содержит: а) 18 электронов и 22
нейтронов; б) 30 электронов и 34 нейтронов; в) 25 электронов и 30 нейтронов.
14.
Приведите полное обозначение нуклида, содержащего: а) 21 нейтрон и 38 других
частиц; б) 44 нейтрона и 70 других частиц; в) 16 нейтронов и 30 других частиц.
15.
Нуклиды элементов X, Y и Z обозначаются так: 18Х, 33Y, 40Z.
Назовите элементы X, Y и Z. Какой состав ядра атома каждого из нуклидов?
16.
Определите относительную атомную массу бора, если известно, что молярная доля
изотопа 10В составляет 19,6%, а изотопа 11В — 80,4%.
17.
Медь имеет два изотопа: 63Сu и 65Сu.
Молярные доли их в природной меди составляют 73 и 27% соответственно. Определите
среднюю относительную атомную массу меди.
18.
Определите относительную атомную массу элемента кремния, если он состоит из
трех изотопов: 28Si (молярная доля 92,3%),
29Si (4,7%) и 30Si
(3,0%).
19.
Природный хлор содержит два изотопа 35Сl
и 37Сl. Относительная атомная масса
хлора равна 35,45. Определите молярную долю каждого изотопа хлора.
20.
Относительная атомная масса неона равна 20,2. Неон состоит из двух изотопов: 20Nе
и 22Nе. Рассчитайте молярную долю каждого изотопа в природном неоне.
21.
Природный бром содержит два изотопа. Молярная доля изотопа 79Вr
равна 55%. Какой еще изотоп входит в состав элемента брома, если его
относительная атомная масса равна 79,9?.









