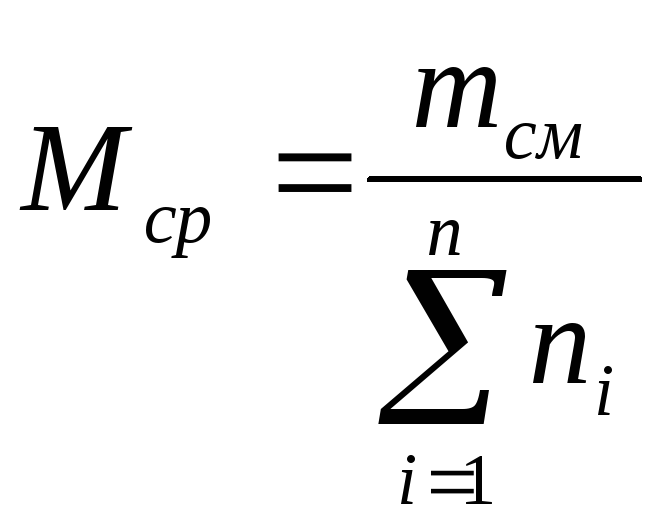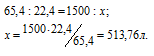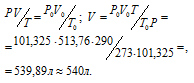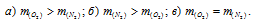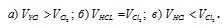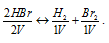Исходя из условия задачи хлорид натрия становится сульфатом натрия(при повышенной температуре)
2NaCl + H2SO4 = Na2SO4 + 2HCl
Возьмём за ҳ(г) содержание смеси NaCl;
(3,750 – ҳ)( г) Na2SO4.
Из 2 молей NaCl (М=58,454)получается 1 моль Na2SO4 (М=142,06),
поэтому ҳ
(г )NaCl дают массу Na2SO4
m = 142, 06 ∙ ҳ / 2 ∙ 58,454( г)Na2SO4
После превращения хлорида в сульфат масса смеси составляет
m1 = 142, 06 ∙ ҳ / 166,908 + (3,750 – ҳ) = 4,234
ҳ = 2,254 (г)
Значит смесь имела процентный состав:
(2,254 : 3,750) ∙ 100 = 60,1% NaCl
100 — 60,1 = 39,9% Na2SO4
Ответ:а)60,1%; б)39,9%
Задачи на растворы, смеси и сплавы относятся к традиционным арифметическим и алгебраическим задачам, решение которых нередко вызывает трудности. Для решения таких задач нужно уметь рассуждать и уметь решать задачи на проценты и дроби, на составление уравнений и систем уравнений.
Давайте, сначала, определим, что это за задачи на смеси и сплавы. Довольно часто приходится смешивать различные жидкости, порошки, разбавлять что-либо водой или наблюдать испарение воды. В задачах такого типа эти операции приходится проводить мысленно и выполнять расчёты, а для этого надо четко понимать, что:
— масса раствора = масса воды + масса соли;
— масса сплава равна сумме масс металлов, входящих в этот сплав;
— масса смеси равна сумме масс компонентов этой смеси.
При решении задач на смеси, растворы и сплавы, мы используем их общее свойство, которое заключается в том, что масса смеси, раствора или сплава равна сумме масс их компонентов.
Введем понятие концентрации или процентного содержания вещества в растворе (смеси, сплаве).
Концентрация соли или процентное содержание соли в растворе — это отношение массы соли к массе раствора, записанное в виде процентов:
K=(mc/M)*100%,
где mс — масса соли, M – масса всего раствора, К – концентрация (процентное содержание) соли.
Концентрация вещества или процентное содержание вещества в смеси — это отношение массы вещества к массе смеси, записанное в виде процентов: K=(mв/M)*100%, где mв — масса вещества, M – масса всей смеси, К – концентрация (процентное содержание) вещества
Концентрация вещества или процентное содержание вещества в сплаве — это отношение массы вещества к массе сплава, записанное в виде процентов : K=(mв/M)*100%, где mв — масса вещества, M – масса всего сплава, К – концентрация (процентное содержание) вещества.
Пример раствора. Возьмем 180 грамм воды и добавим в воду 20 грамм соли. Получим раствор, его масса равна 180 + 20 = 200 грамм. Определим концентрацию соли (процентное содержание соли) в растворе: К= (20/(180+20))*100%=10% . Тогда процентное содержание воды 90%. (100%-10%=90%). Процентное содержание воды можно определить и так: Кв=(180/(180+20))*100%=90%. Результаты запишем в виде таблицы.
| соль | 20гр | 10% |
| вода | 180гр | 90% |
| раствор | 200гр | 100% |
Пример смеси. Возьмем и перемешаем одно ведро цемента с тремя ведрами песка. Получим смесь цемента с песком, её масса равна 1 + 3 = 4 (единиц массы). Определим концентрацию (процентное содержание) цемента в смеси : К=(1/(1+3))*100%=25%.. Концентрация (процентное содержание) песка в смеси 100%-25%=75%.
Результаты запишем в виде таблицы.
| цемент | 1 ведро | 25% |
| песок | 3ведра | 75% |
| смесь | 4 ведра | 100% |
Пример сплава. Сплав цинка и меди массой 600 гр. содержит 270 гр.меди. Определим концентрацию (процентное содержание) меди в сплаве:
Км= (270/600)*100%= 45%.
Концентрация (процентное содержание) цинка в смеси:
100%-45%=55%. Или Кц=((600-270)/600))*100%= 55%.
Результаты запишем в виде таблицы.
| цинк | 330 | 55% |
| медь | 270 | 45% |
| сплав | 600гр | 100% |
Масса вещества в растворе, смеси, сплаве.
Из формулы K=(m/M)*100%, где m масса вещества, М — масса всего раствора ( смеси, сплава), получим, что масса вещества в растворе находится по формуле: m=(M*K)/100%.
Например: а) Имеется 200 гр 40% раствора соли. Определите массу соли.
Решение : mc = (200*40%)/100 = 80г. Ответ: 80 г
б) Сплав меди и цинка массой 900г содержит 64% меди. Определите массу цинка в сплаве.
Решение: 1 способ. 100% — 64% = 36% цинка в смеси,
mц=(900*36%)/100%=324г.
2 способ. mм= (900*64%)/100%=576г, 900 – 576 = 324 г.
Ответ: 324г.
.
Последнее изменение: Четверг, 24 июля 2014, 21:53
Смесь, состоящая из
двух и более компонентов, характеризуется
свойствами и содержанием этих компонентов.
Состав смеси может быть задан массой,
объемом, количеством (числом молей или
килограмм-молей) отдельных компонентов,
а также значениями их концентраций.
Концентрацию компонента в смеси можно
выразить в весовых, мольных и объемных
долях или процентах, а также в других
единицах.
Массовая
доля i
какого-либо компонента определяется
отношением массы mi
данного компонента к массе всей смеси
mсм:
Учитывая,
что суммарная масса смеси равна сумме
масс отдельных компонентов, т.е.
можно написать:
или сокращенно:
Пример
4. Смесь
состоит из двух компонентов: m1
= 500 кг, m2
= 1500 кг. Определить массовую долю каждого
компонента в смеси.
Решение.
Массовая
доля первого компонента:
mсм=
m1
+ m2
= 500 + 1500 = 2000 кг
Массовая доля второго компонента:
Массовую
долю второго компонента можно определить
также, используя равенство:
1
+ 2
= 1
2
= 1 – 1
= 1 – 0,25 = 0,75
Объемная
доля i
компонента в смеси равна отношению
объема Vi
данного компонента к объему всей смеси
V:
Учитывая, что:
можно написать:
Пример
5.
Газ состоит из двух компонентов: V1
= 15,2 м3
метана и V2
= 9,8 м3
этана. Подсчитать объемный состав смеси.
Решение.
Общий объем смеси равен:
V
= V1
+ V2
= 15,2 + 9,8 = 25 м3
Объемная доля в смеси:
метана
этана
v2
= 1 – v1
= 1 – 0,60 = 0,40
Мольная
доля ni
какого-либо компонента смеси определяется
как отношение числа киломолей Ni
данного компонента к общему числу
киломолей N
смеси:
Учитывая,
что:
получим:
Пересчет мольных
долей в массовые можно проводить по
формуле:
Пример
6. Смесь
состоит из 500 кг бензола и 250 кг толуола.
Определить мольный состав смеси.
Решение.
Молекулярный
вес бензола (С6Н6)
равен 78, толуола (С7Н8)
– 92. Число килограмм-молей равно:
бензола
толуола
общее число
килограмм-молей:
N
= N1
+ N2
= 6,41 + 2,72 = 9,13
Мольная доля
бензола равна:
Для толуола мольная
доля может быть найдена из равенства:
n1
+ n2
= 1
откуда: n2= 1 –n1= 1 – 0,70 = 0,30
Среднюю молекулярную
массу смеси можно определить, зная
мольную долю и молекулярную массу
каждого компонента смеси:
(21)
где
ni
— содержание
компонентов в смеси, мол. доли; Mi
— молекулярная
масса компонента смеси.
Молекулярную массу смеси нескольких
нефтяных фракций можно определить по
формуле

или
(23)
где
m1,
m2,…,
mn
— масса
компонентов смеси, кг; M1,
М2,….,.Мп
— молекулярная масса компонентов смеси;
— % масс. компонента.
Молекулярную
массу нефтепродукта можно определить
также по формуле Крэга

Пример
7.
Определить среднюю молекулярную массу
смеси бензола с изооктаном, если мольная
доля бензола составляет 0,51, изооктана
0,49.
Решение.
Молекулярная масса бензола 78, изооктана
114. Подставляя эти значения в формулу
(21), получаем
Мср
= 0,51
78 + 0,48114
= 95,7
Пример
8. Смесь
состоит из 1500кг бензола и 2500кг н-октана.
Определить среднюю молекулярную массу
смеси.
Решение.
Используем формулу (22)
Объемный
молярный состав пересчитывают в массовый
следующим образом. Данный объемный
(молярный) состав в процентах принимают
за 100 молей. Тогда концентрация каждого
компонента в процентах будет выражать
число его молей. Затем число молей
каждого компонента умножают на его
молекулярную массу и получают массу
каждого компонента в смеси. Разделив
массу каждого компонента на общую массу,
получают его массовую концентрацию.
Массовый
состав пересчитывают в объемный
(молярный) следующим образом. Принимают,
что смеси взято 100 (г, кг, т) (если массовый
состав выражен в процентах), массу
каждого компонента делят на его
молекулярную массу. Получают число
молей. Делением числа молей каждого
компонента на их общее число получают
объемные (молярные) концентрации каждого
компонента.
Средняя плотность
газа определяется по формуле:
кг/м3;
г/см3
или, исходя из
объемного состава:
,
или, исходя из
массового состава смеси:

Относительную плотность определяют по
формуле:
Пример 9.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
массовый % масс. |
mi |
Число
|
Объемный |
|
|
доли единицы |
% об. |
|||||
|
Метан |
16 |
40 |
40 |
40:16=2,50 |
0,669 |
66,9 |
|
Этан |
30 |
10 |
10 |
10:30=0,33 |
0,088 |
8,8 |
|
Пропан |
44 |
15 |
15 |
15:44=0,34 |
0,091 |
9,1 |
|
Бутан |
58 |
25 |
25 |
25:58=0,43 |
0,115 |
11,5 |
|
Пентан + высшие |
72 |
10 |
10 |
10:72=0,14 |
0,037 |
3,7 |
|
100 |
100 |
3,74 |
1,000 |
100,0 |
Для
простоты расчета примем массу смеси за
100 г, тогда масса каждого компонента
будет численно совпадать с процентным
составом. Найдем число молей ni
каждого компонента. Для этого массу
каждого компонента mi
разделим на мольную массу:
Находим объемный
состав смеси в долях единицы
i(CH4)
= 2,50 : 3,74 = 0,669;
(C2H6)
= 0,33 : 3,74 = 0,088;
(C5H8)
= 0,34 : 3,74 = 0,091;
(C4H10)
= 0,43 : 3,74 = 0,115;
(C5H12)
= 0,14 : 3,74 = 0,037.
Находим
объемный состав смеси в процентах,
умножив данные в долях единицы на 100%.
Все полученные данные заносим в таблицу.
Рассчитываем
среднюю массу смеси.
Мср
= 100 : 3,74 =
26,8 г/моль
Находим
плотность смеси
Находим относительную
плотность:
Пример 10.Пересчитать объемный
состав в массовый и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
Объемный % об. |
число |
Масса г. |
Весовой |
|
|
доли единицы |
% масс. |
|||||
|
Метан |
16 |
30 |
30 |
3016=480 |
0,117 |
11,7 |
|
Этан |
30 |
15 |
15 |
15·30=450 |
0,109 |
10,9 |
|
Пропан |
44 |
20 |
20 |
20·44=880 |
0,214 |
21,4 |
|
Бутан |
58 |
15 |
15 |
15·58=870 |
0,211 |
21,1 |
|
Пентан + высшие |
72 |
20 |
20 |
20·72=1440 |
0,349 |
34,9 |
|
100 |
100 |
4120 |
1,000 |
100,0 |
(CH4)
= 480 : 4120 = 0,117;
(C2H6)
= 450 : 4120 = 0,109;
(C3H8)
= 880 : 4120 = 0,214;
(C4H10)
= 870 : 4120 = 0,211;
(C5H12)
= 1440 : 4120 = 0,349.
Мср
= 4120 : 100 =
41,2 г/моль.
г/л
Задача 15. Смесь состоит из пяти
компонентов. Определить массовую,
объемную и мольную долю каждого компонента
в смеси, среднюю молекулярную массу
смеси.
|
Компоненты смеси |
Вариант |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
mi |
mi |
mi |
||||||||
|
метан |
5 |
30 |
55 |
80 |
100 |
75 |
50 |
25 |
5 |
30 |
|
этан |
10 |
35 |
60 |
85 |
95 |
70 |
45 |
20 |
10 |
35 |
|
пропан |
15 |
40 |
65 |
90 |
90 |
65 |
40 |
15 |
15 |
40 |
|
н-бутан |
20 |
45 |
70 |
95 |
85 |
60 |
35 |
10 |
20 |
45 |
|
изобутан |
25 |
50 |
75 |
100 |
80 |
55 |
30 |
5 |
25 |
50 |
Задача 16.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
ω% массовый |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
|
этан |
50 |
45 |
40 |
35 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пропан |
5 |
10 |
20 |
10 |
5 |
10 |
15 |
20 |
25 |
30 |
|
бутан |
10 |
10 |
20 |
15 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пентан |
30 |
25 |
5 |
20 |
10 |
20 |
10 |
10 |
10 |
10 |
Задача 17. Пересчитать объемный
состав газа в массовый и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
объемный состав |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
10 |
5 |
20 |
5 |
20 |
10 |
10 |
35 |
40 |
10 |
|
этан |
45 |
50 |
15 |
20 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пропан |
10 |
5 |
10 |
20 |
10 |
5 |
25 |
15 |
20 |
30 |
|
бутан |
10 |
10 |
35 |
40 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пентан |
15 |
30 |
20 |
15 |
30 |
25 |
45 |
10 |
10 |
50 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
Решение задач на газовые смеси | Закон Авогадро
Задача 71.
При прохождении смеси равных объемов SO2 и О2 через контактный аппарат 90% молекул SO2 превращается в SO3. Определить состав (в процентах по объему) газовой смеси, выходящей из контактного аппарата.
Решение:
Уравнение реакции горения сернистого газа имеет вид:
2SO2 + O2 = 2SO3 .
Из уравнения реакции вытекает, что из двух молекул SO2 и одной молекулы O2 образуются две молекулы SO3. Известно, что из каждого литра SO2 превратилось в SO3 0,9л, при этом образовалось тоже 0,9л SO3. Кислорода на каждый литр прореагировало соответственно 0,45л О2 (0,9/2 = 0,45).
Таким образом, выходящая смесь газов из контактного аппарата, на каждый литр смеси состояла из 0,1л SO2 (1 – 0,9 = 0,1) и 0,55л О2 (1 – 0,45 = 0,55). Общий объём смеси, выходящей из контактного аппарата, составляет 1,55л (0,1 + 0,55 + 0,9 = 1,55).
Задача 72.
Смесь, состоящая из трех объемов Сl2 и одного объема H2, оставлена в закрытом сосуде на рассеянном свету при постоянной температуре. Через некоторое время содержание Сl2 в смеси уменьшилось на 20%. Изменилось ли давление в сосуде? Каков процентный состав смеси по объему?
Решение:
Уравнение реакции взаимодействия хлора с водородом имеет вид:
Cl2 + H2 = 2HCl
При взаимодействии одного моля хлора с одним моль водорода образуется два объёма хлороводорода, т. е. реакция идёт без изменения объёма. При нормальных условиях из трёх литров хлора в реакцию вступило 0,6л (3 . 0,2 = 0,6). Точно такое же количество водорода тоже вступило в реакцию. Таким образом, при взаимодействии 0,6л хлора и 0,6л водорода образовалось 1,2л хлороводорода (2 . 3 = 0,6). Так как реакция идёт без изменения объёма, то давление в системе тоже не изменится.
Находим процентный состав газовой смеси по формуле:
Ответ: не изменилось;

Задача 73.
При взаимодействии NН3 с Сl2 образуются хлороводород и азот. В каких объемных соотношениях взаимодействуют NH3 и С12 и каково отношение объемов получающихся газов?
Решение:
Уравнение реакции взаимодействия аммиака с хлором имеет вид:
2NH3 + 3Cl2 = 6HCl + N2
При взаимодействии аммиака с хлором из каждых двух объёмов аммиака и трёх объёмов хлора образуются шесть объёмов хлороводорода и один объём азота. Таким образом, аммиак и хлор взаимодействуют в объёмных отношениях 2 : 3 (2VNH3 : 3VCl), а отношение объёмов получающихся газов – 1 : 6 V(N2 : V(HCl).
Ответ: V(NH3) : V(Cl2) = 2 : 3; V(HCl) : V(N2) = 6 : 1.
Задача 74. Какой объем Н2 (при 17 °С и давлении 102,4кПа) выделится при растворении 1,5кг цинка в соляной кислоте?
Решение:
Уравнение реакции имеет вид:
Zn + 2HCl = ZnCl2 + H2↑
Зная мольную массу цинка (65,4г/моль) и мольный объём газа (22,4л), находим объём водорода, который выделится при растворении 1,5кг цинка из пропорции:
Затем приводим полученный объём к указанным условиям используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
где P и V — давление и объём газа при температуре T = 290К (273 +17 = 290); P0 = 101,325 кПа; T0 = 273 К; P = 102,4 кПа; V0 -объём газа (н.у.) = 513,76 л.
Ответ: 540л.
Задача 75.
После взрыва смеси, состоящей из одного объема исследуемого газа и одного объема Н2, получился один объем водяного пара и один объем азота. Все измерения производились при одинаковых условиях. Найти формулу исследуемого газа.
Решение:
Молекулярная формула воды H2O, а азота – N2. Так как продукты реакции и исходные вещества состоят из одинаковых объёмов, то, учитывая, что образуются по одной молекуле воды и азота из одной молекулы водорода и одной молекулы исследуемого газа, можно предположить, что молекула исследуемого газа состоит из двух атомов азота и одного атома кислорода. Следовательно, формула исследуемого газа имеет вид N2O.
Ответ: N2O.
Задача 76
При одинаковых условиях взяты равные объемы N2 и O2. Каково соотношение масс обоих газов:
Решение:
Согласно закону Авогадро, в равных объёмах любых газов, взятых при одинаковых условиях (одной и той же температуре и одинаковом давлении) содержится одинаковое число молекул (6,02 . 1023). Поскольку M(O2) равен 32 г/моль, а M(N2) – 28г/моль, то m(O2) > m(N2)
Ответ: а).
Задача 77.
Смешали равные объемы Н2 и С12. Как изменится объем смеси после протекания реакции: а) не изменится;
б) увеличится в два раза; в) уменьшится в два раза?
Решение:
Уравнение реакции взаимодействия хлора с водородом имеет вид:
Cl2 + H2 = 2HCl
При взаимодействии одного моля хлора с одним моль водорода образуется два объёма хлороводорода, т.е. реакция идёт без изменения объёма. Поэтому объём смеси после протекания реакции не изменится.
Ответ: а).
Задача 78.
Каково соотношение объемов, занимаемых 1 моль НСI и 1 моль Сl2 (Т и Р одинаковы):
Решение:
Согласно закону Авогадро одно и тоже число молекул любого газа занимает при одинаковых условиях (температура и давление одинаковы) один и тот же объём. Вместе с тем 1 моль любого газа содержит одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объём. Этот объём называется мольным объёмом газа и при нормальных условиях (Т = 0 °С и Р = 101,325 кПа) равен 22,4л. Поэтому соотношение объёмов одного моля HCl и одного моля Cl2 (T и Р одинаковы):
V(HCl) = V(Cl2).
Ответ: б).
Задача 79.
При нагревании НВг полностью разлагается. При этом объём газа не изменяется. Каковы продукты реакции разложения: а) атомы Н и Вг; б) молекулы Н2 и Вг2 в) молекулы Н2 и атомы Br?
Решение:
Уравнение реакции термического разложения бромоводорода имеет вид:
Таким образом, из двух молекул НВг образуются одна молекула Н2 и одна молекула Вг2, т.е. объём системы после реакции не изменяется. Следовательно, продуктами реакции термического разложения HBr являются газообразные Н2 и Вг2.
Ответ: б).
Как вычислить процентную концентрацию раствора
Задания на вычисление процентной концентрации растворов приходится выполнять не только при изучении раздела химии. Умение проводить соответствующие расчеты могут сослужить хорошую службу в повседневной жизни, например, при перерасчете концентрации раствора уксусной кислоты в период консервирования овощей.

Вам понадобится
- — калькулятор.
Инструкция
Любой раствор состоит из растворенного вещества и растворителя. В большинстве случаев растворителем выступает вода. Чтобы вычислить процентную концентрацию (или массовую долю растворенного вещества) необходимо воспользоваться формулой:W = m (растворенного вещества) / m (раствора) х 100 %W – массовая доля растворенного вещества (или процентная концентрация), %Из этой же формулы можно вывести и массу растворенного вещества, если известны масса раствора и процентная концентрация раствора.
Пример № 1. Вычислите массовую долю (в процентах) поваренной соли (NaCl), если масса (NaCl) 5 г, а масса раствора (NaCl) 100 г.В данной задаче остается только подставить в формулу предложенные в условии параметры:W = m (р. в-ва) / m (р-ра) х 100 %W (NaCl) = m (NaCl) / m (раствора NaCl) х 100 %W (NaCl) = 5 г / 100 г х 100 % = 5 %Ответ: W (NaCl) = 5 %
Пример № 2. Вычислите массовую долю (в процентах) бромида калия (KBr), если масса соли (KBr) 10 г, а масса воды 190 г.Прежде чем работать с формулой на вычисление процентной концентрации, рассчитайте массу раствора, который состоит из воды и растворенного вещества:m (раствора) = m (растворенного вещества) + m (воды) Следовательно:m (р-ра KBr) = 10 г + 190 г = 200 гПодставьте в основную формулу найденные и указанные в условии параметры:W = m (р. в-ва) / m (р-ра) х 100 %W (KBr) = m (KBr) / m (раствора KBr) х 100 %W (KBr) = 10 г / 200 г х 100 % = 5 %Ответ: W (KBr) = 5 %
Пример № 3. Вычислите процентную концентрацию уксусной кислоты (СН3СООН), если масса кислоты (СН3СООН) 30 г, а масса воды 170 г.Рассчитайте массу раствора, который состоит из воды и уксусной кислоты:m (раствора) = m (растворенного вещества) + m (воды) Следовательно:m (р-ра СН3СООН) = 30 г + 170 г = 200 гПодставьте в формулу необходимые параметры:W = m (р. в-ва) / m (р-ра) х 100 %W (СН3СООН) = m (СН3СООН) / m (раствора СН3СООН) х 100 %W (СН3СООН) = 30 г / 200 г х 100 % = 15 %Ответ: W (СН3СООН) = 15 %
Источники:
- процентная доля раствора
- Решение задач на понятия «процентное содержание
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.