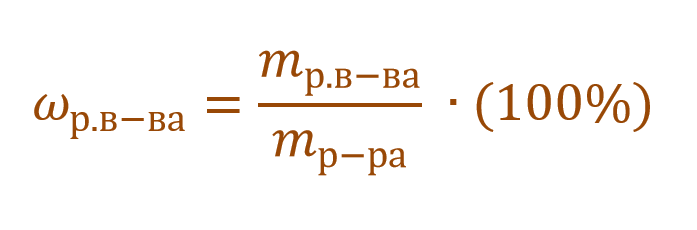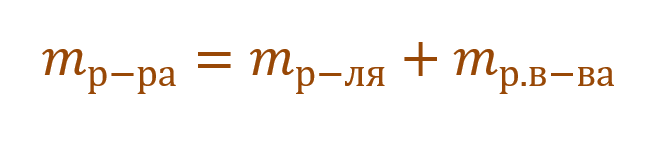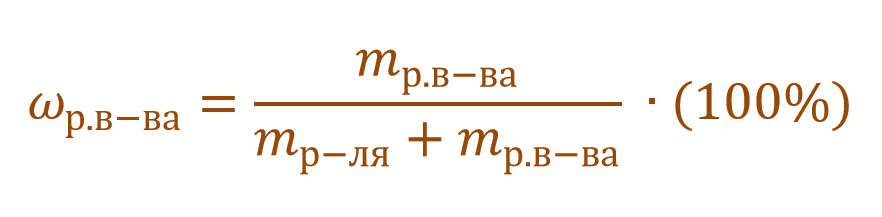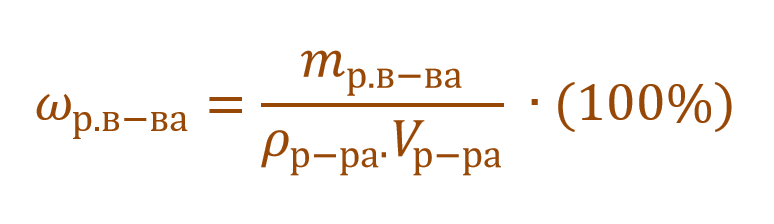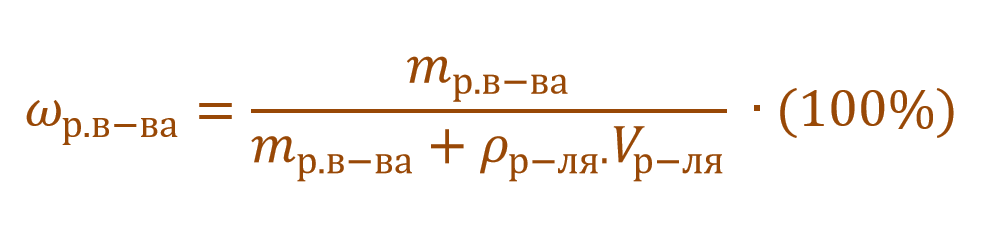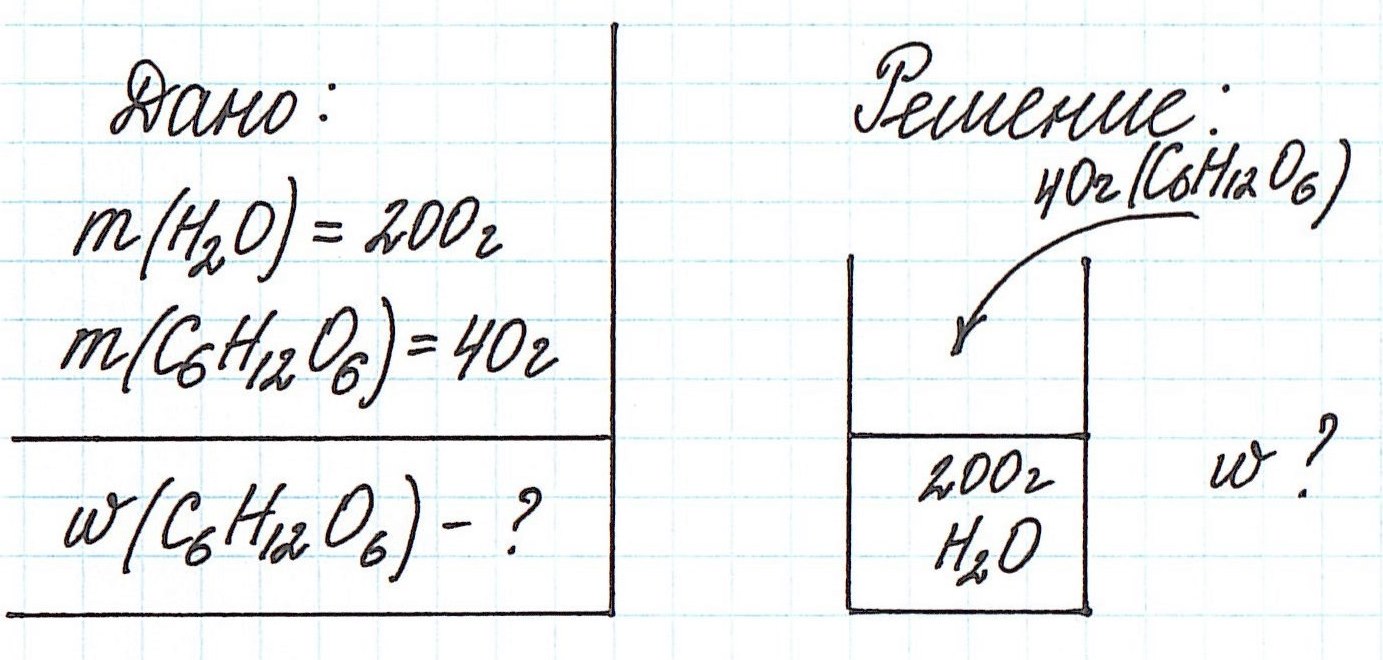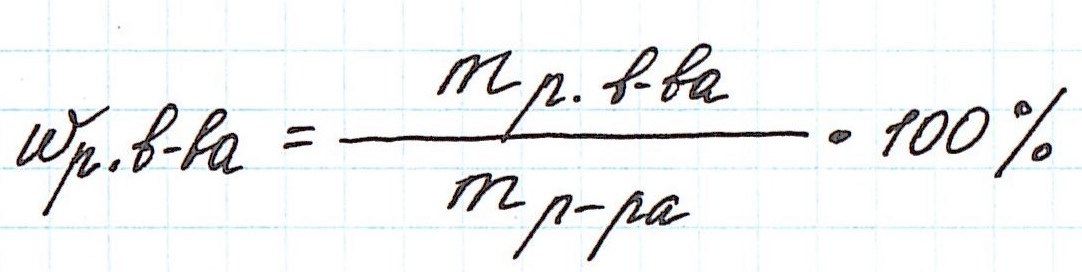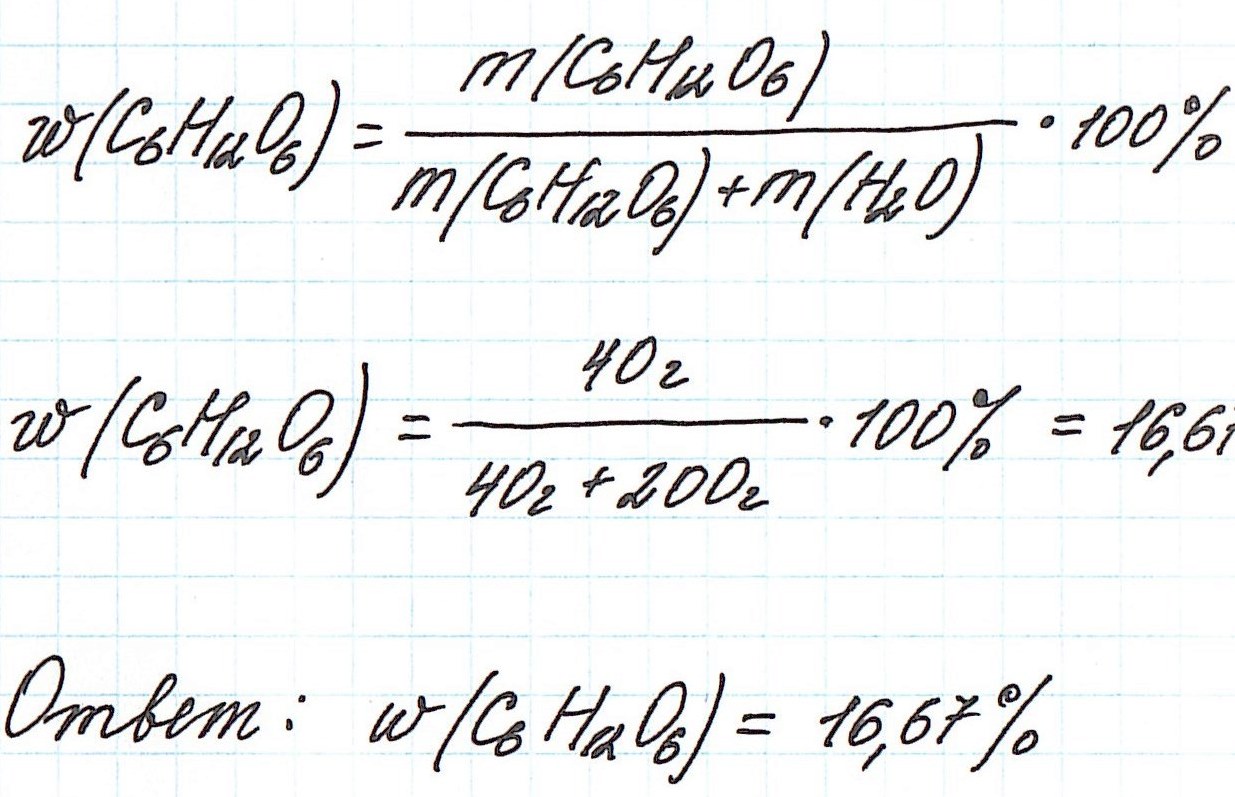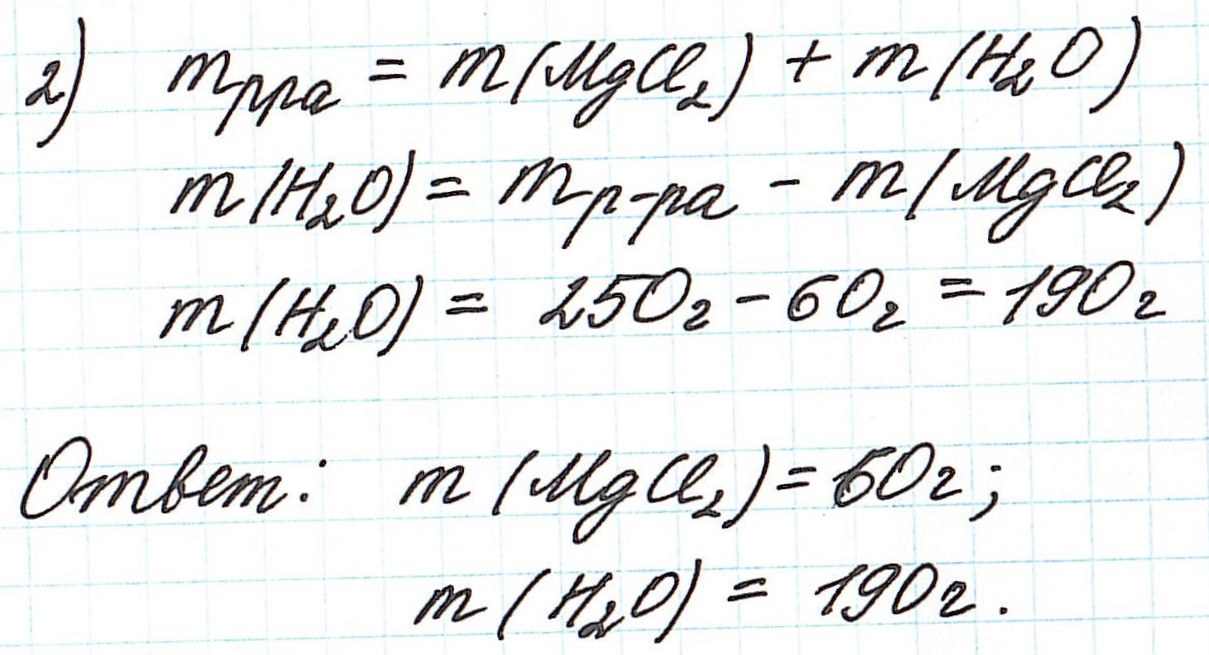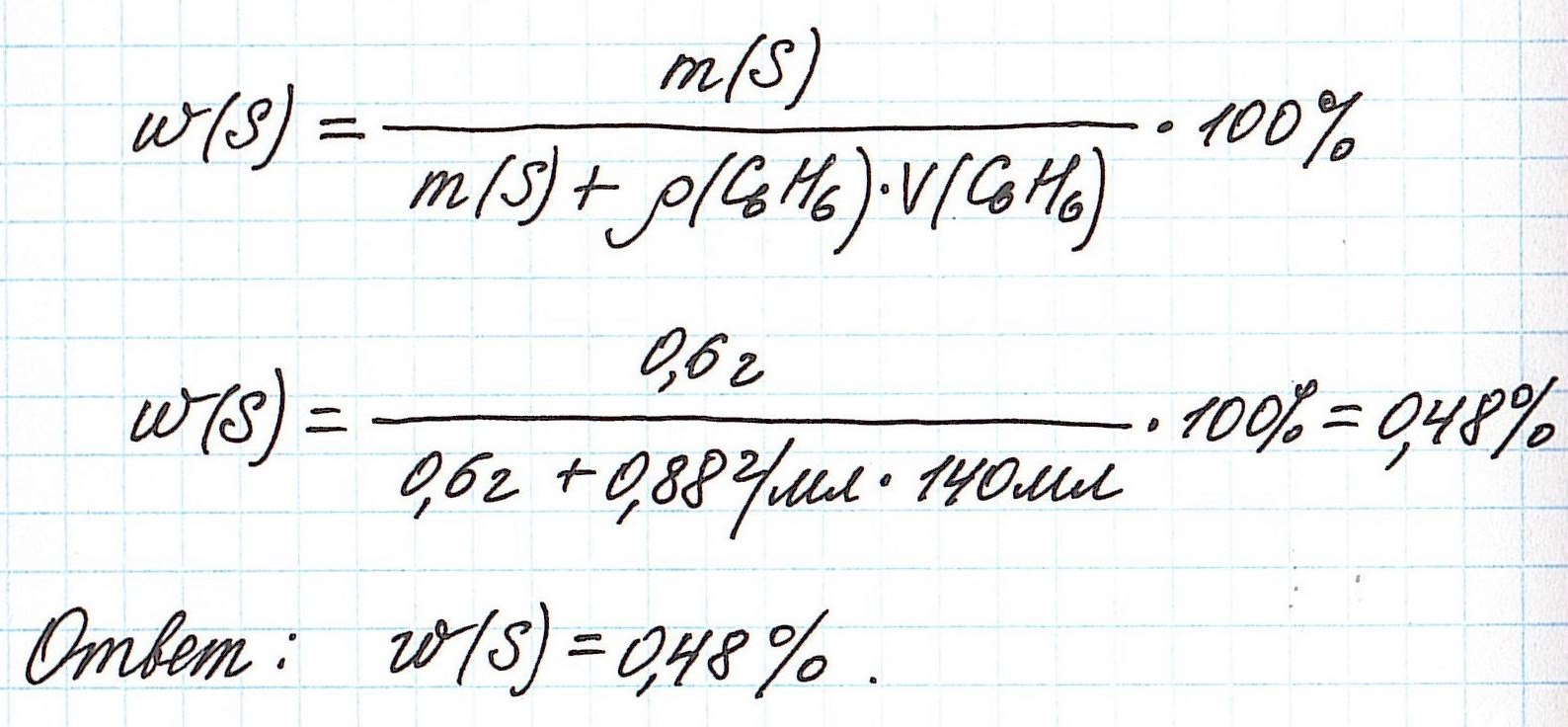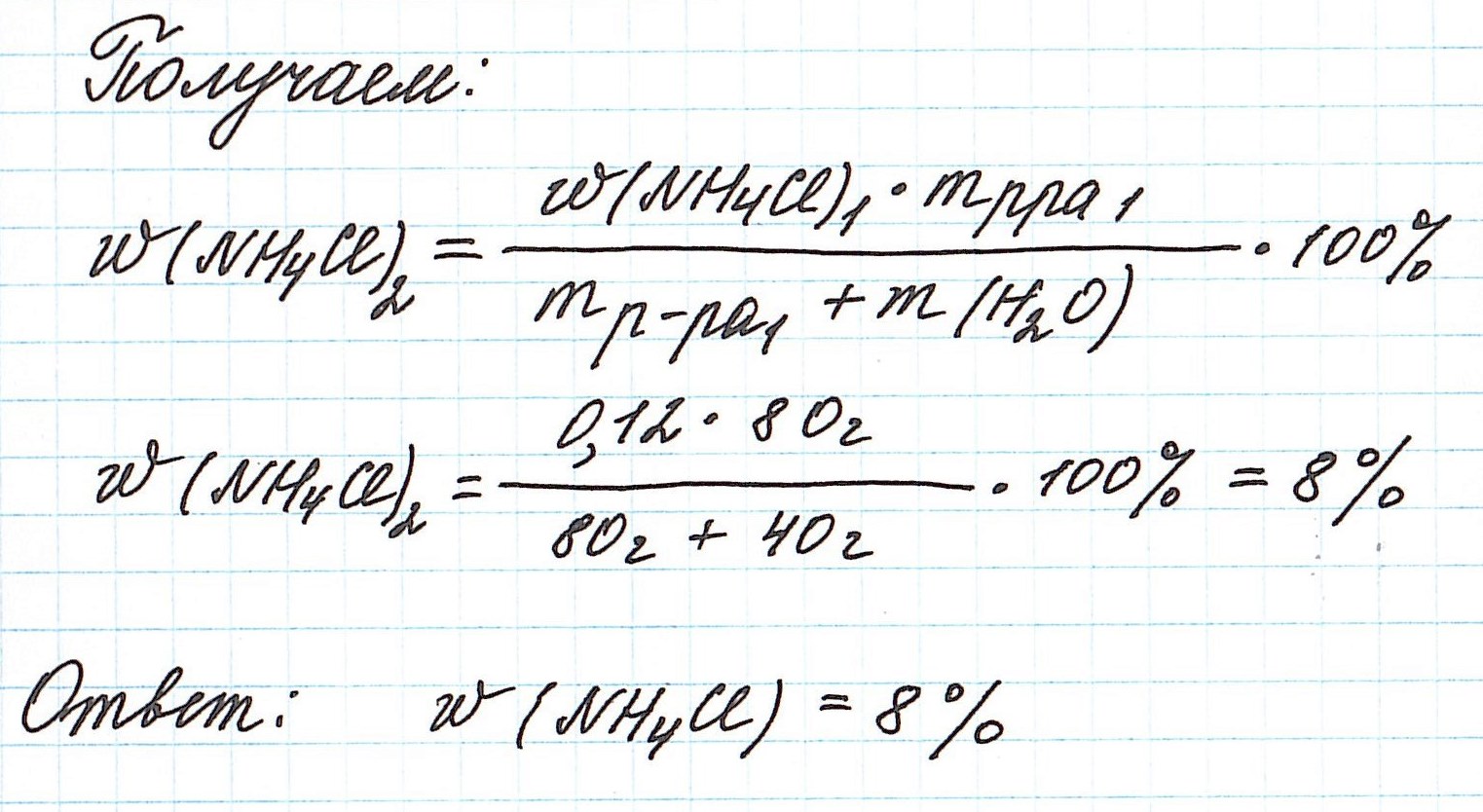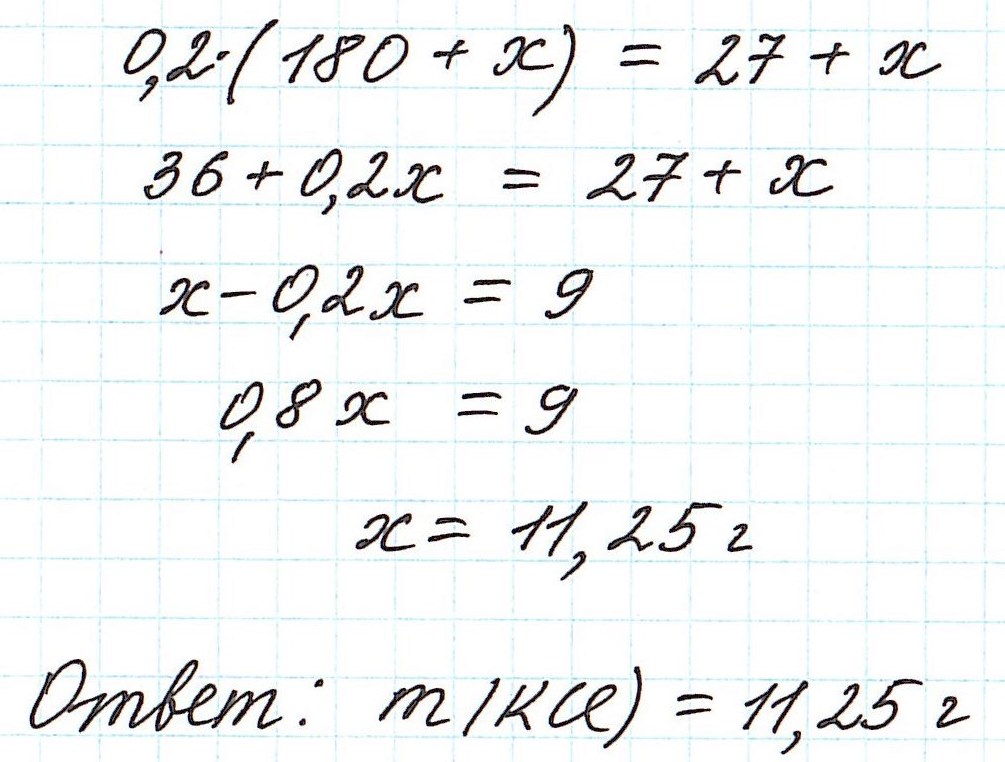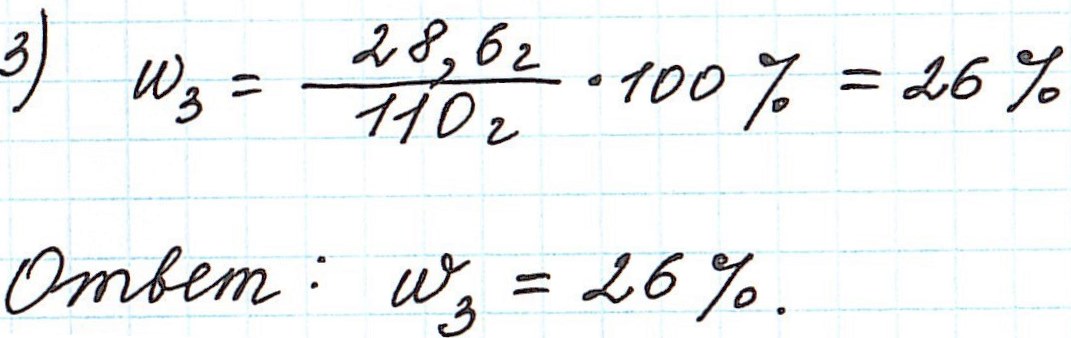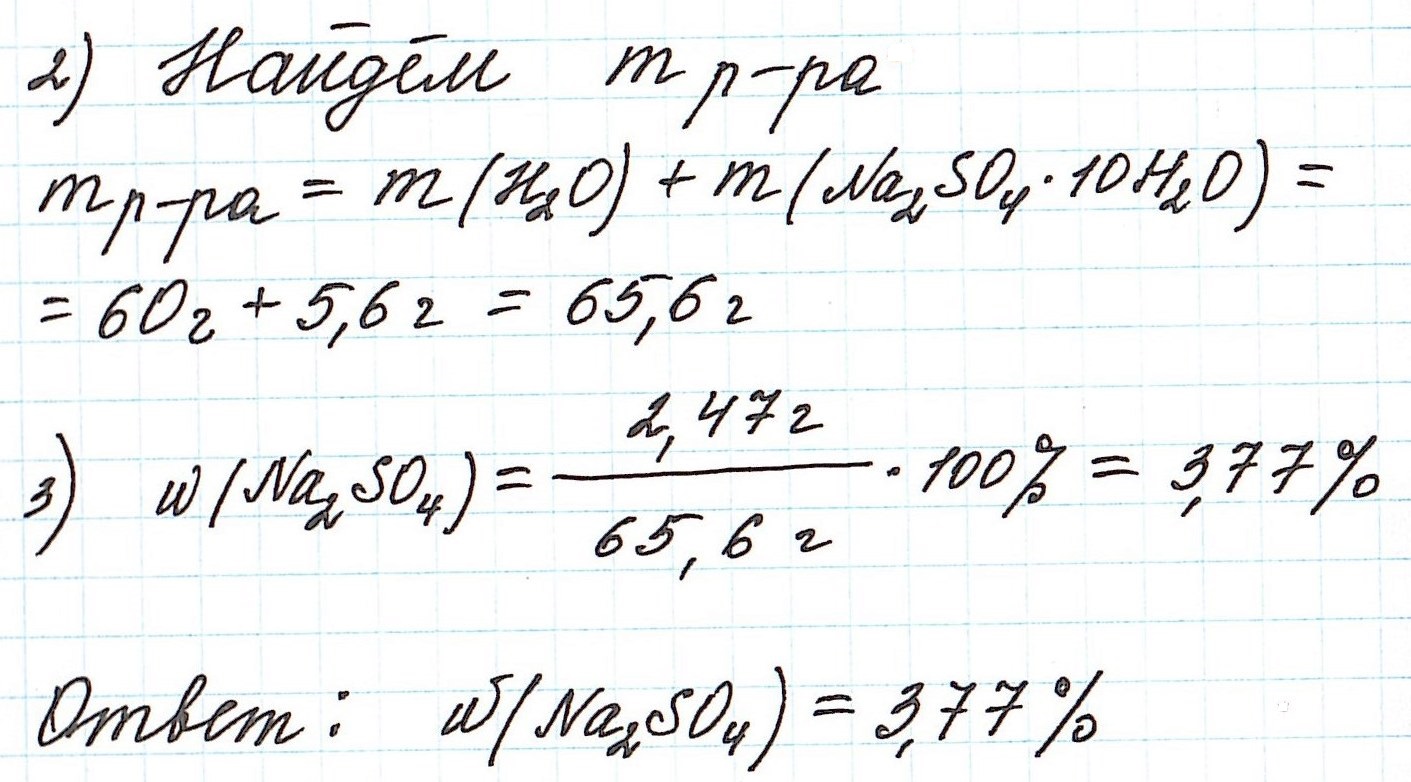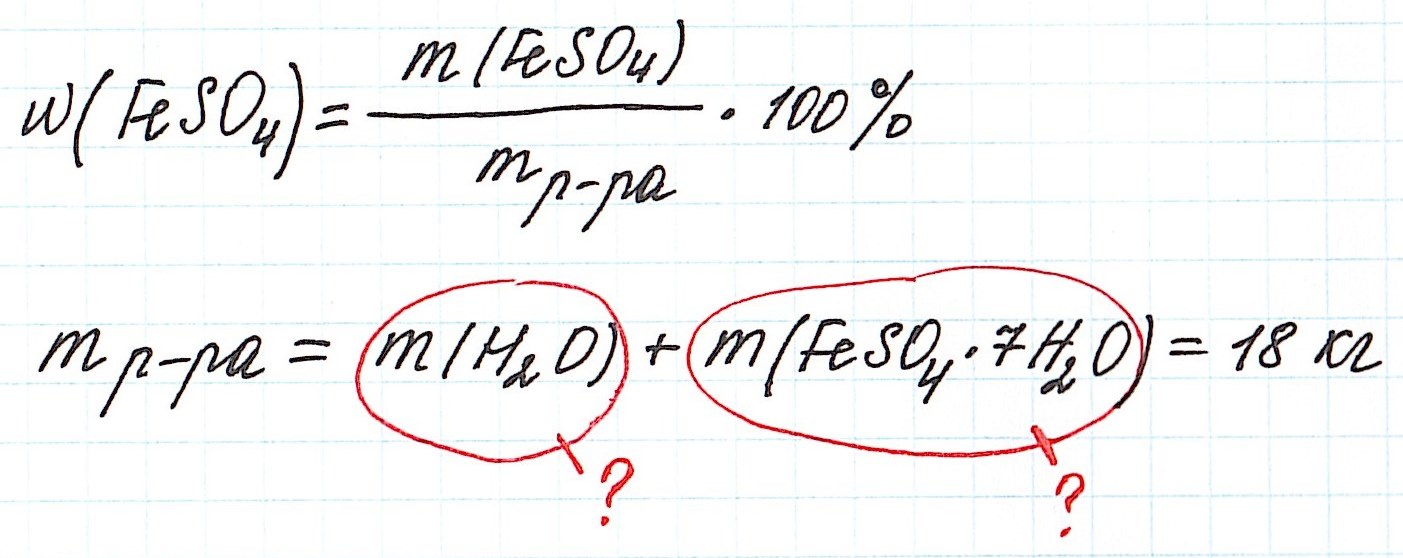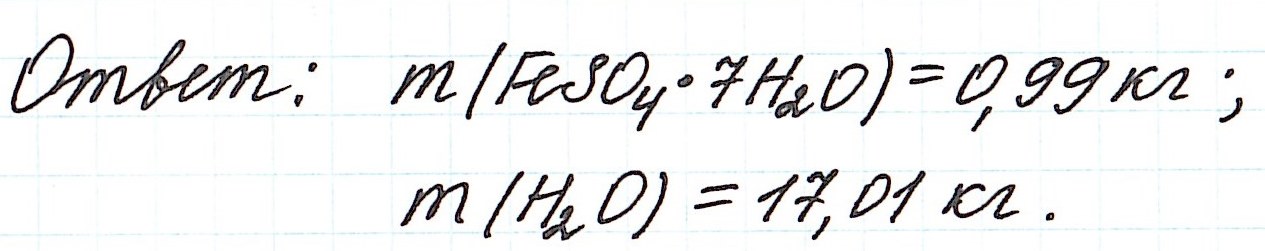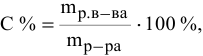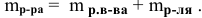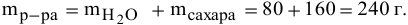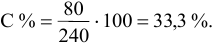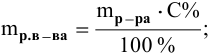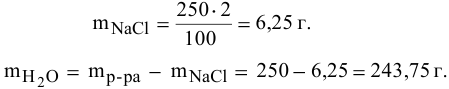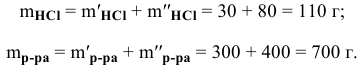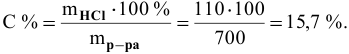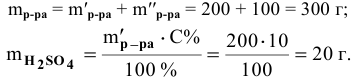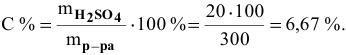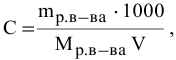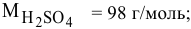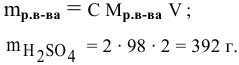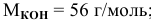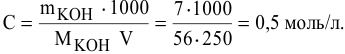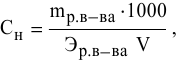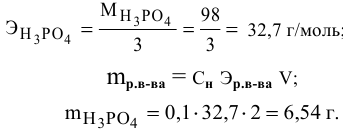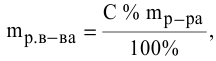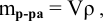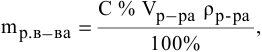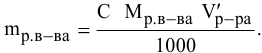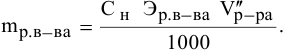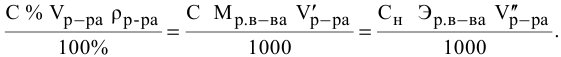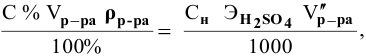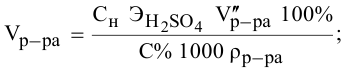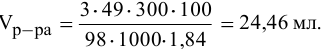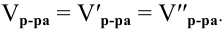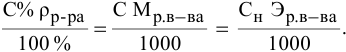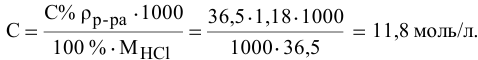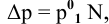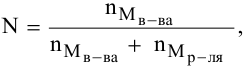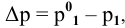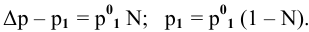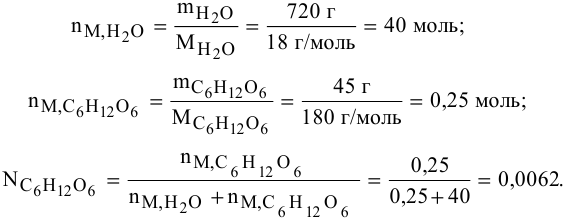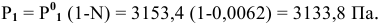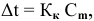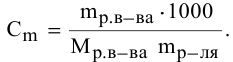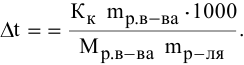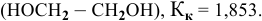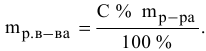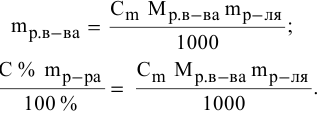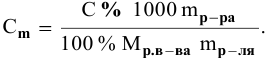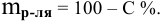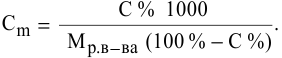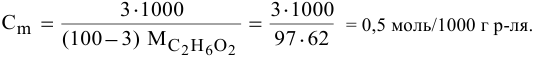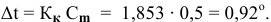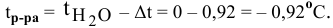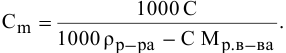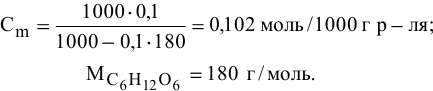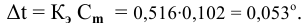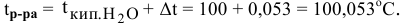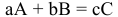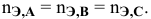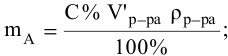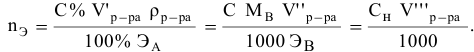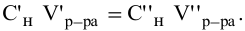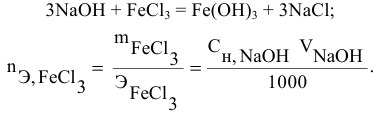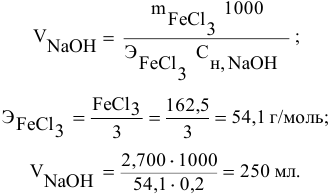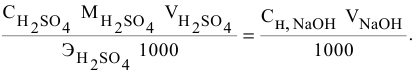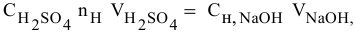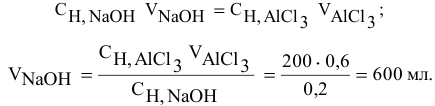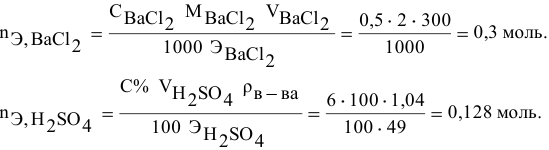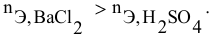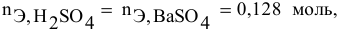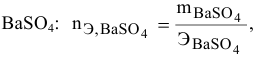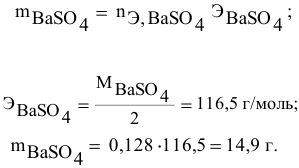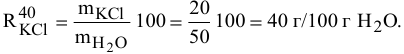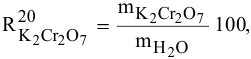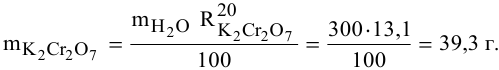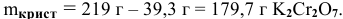Методы определения концентрации растворов
Концентрацию
растворов можно определять различными
методами:
1) По плотности
раствора, когда не требуется большой
точности;
2) Титрованием,
если значение концентрации необходимо
определить с точностью до 0,01%.
Плотность
раствора определяется по формуле:
,
где m
– масса раствора, г;
V
– объем раствора, мл.
Определение
плотности проще всего производить при
помощи ареометра. Не существует
универсального ареометра. Каждый
ареометр предназначен для жидкостей,
значения плотностей которых лежат в
определенных пределах. Поэтому при
выборе ареометра необходимо, чтобы
ориентировочное значение плотности
данного раствора попадало в интервал
шкалы данного ареометра.
Так как плотность
раствора обусловлена его концентрацией,
то измерив ареометром плотность, можно
по таблицам найти массовую долю
растворённого вещества в растворе
(таб.1).
Титрование
– определение неизвестной концентрации
одного раствора по известной концентрации
другого путем измерения объемов
реагирующих растворов.
Согласно
закону эквивалентов
вещества вступают и образуются в
результате реакции в эквивалентных
количествах. Следовательно, в процессе
титрования νэ(1)=νэ(2).
Выразим количества эквивалентов
реагирующих веществ через объемы (V)
растворов и молярные концентрации их
эквивалентов Сэ,
тогда
V(1)
∙ Сэ(1)
= V(2)
∙ Сэ(2),
или
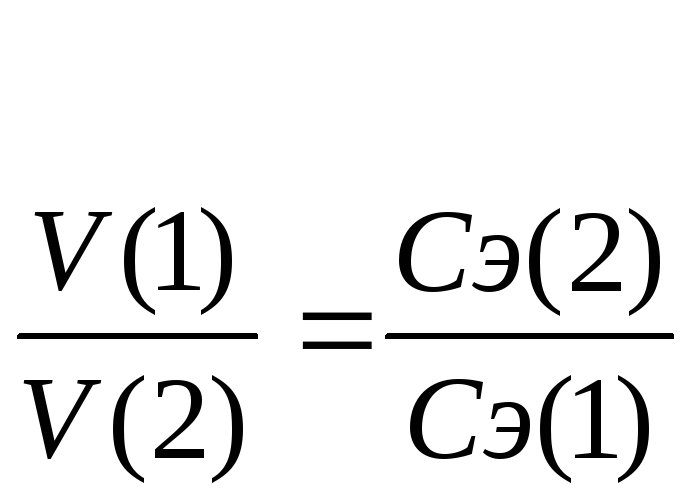
Эти два соотношения
называются формулами
титрования.
Способы приготовления растворов заданной концентрации
Растворы
заданной концентрации можно приготовить
различными способами:
1. Растворением вещества в растворителе
Пример 1.
Приготовить 50 г 5% раствора хлорида
натрия NaCl.
Решение.
Для этого необходимо рассчитать, какую
массу (г) хлорида натрия и массу воды
(г) нужно взять для приготовления 50 г 5%
раствора.
По определению
массовой доли в 100 г 5% раствора содержатся
5 г хлорида натрия, а в 50 г 5% раствора
будет содержаться Х г хлорида натрия.
Отсюда: Х =
= 2,5гNaCl,
тогда легко вычислить массу воды:
50г
– 2,5г = 47,5г.
Если
воспользоваться формулой (2), то решение
будет следующим: ω
=
∙ 100% →
→ m(
р.в. )= ω
∙ m
(р-ра) /100% = 5% ∙ 50 г / 100% = 2,5 г
m
(H2O)
= m
(р-ра) – m
(р.в.) = 50 г – 2,5 г = 47,5 г
Таким образом,
для приготовления раствора данной
концентрации, необходимо на весах
взвесить 2,5г NaCl
и растворить его в 47,5 мл воды (учитывая,
что плотность воды равна 1 г/мл, объем
воды будет равен ее массе).
Пример 2.
Приготовить 100 мл раствора сульфата
меди с молярной концентрацией 0,1 моль/л
сульфата меди.
Решение.
По определению молярной концентрации
в 1000 мл раствора содержится 0,1 моль
CuSO4,
а в 100 мл раствора будет содержаться х
моль CuSO4.
х =
= 0,01 моль
Из соотношения
(4) следует m= ν∙М, т.к. М (CuSO4)
= 160 г/моль, то
m
= 0,01 моль ∙160 г/моль = 1,6 г
Если
воспользоваться формулой (5), то решение
будет следующим:
С
=
→ m
= С ∙ М ∙ V
= 0,01моль/л ∙ 160 г/моль ∙ 0,1 л = 1,6 г
Таким образом,
для того, чтобы приготовить 100 мл раствора
с концентрацией 0,1 моль/л CuSO4,
необходимо
на весах взвесить 1,6 г
CuSO4,
перенести
в мерную колбу на 100 мл и довести объем
раствора в колбе до метки.
Пример 3.
Приготовить 200 мл раствора NaОН
с 0,5 молярной концентрацией эквивалента
NaОН.
Решение.
Из уравнения (7)
находим массу NaОН
Сэ
=
→m=
Сэ
∙ Vэ
∙ Мэ
зная, что Мэ
(NaОН)
=
= 40г /моль, тогда m =0,5 моль/л
∙ 0,2 л ∙ 40 г/моль = 4 г
Итак, для
приготовления 200 мл раствора с 0,5 молярной
концентрацией эквивалента NaОН
необходимо взвесить 4 г NaОН,
перенести в мерную колбу на 200 мл и
довести объем раствора в колбе до метки.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Практическое занятие № 5
Тема: Решение
задач на вычисление концентрации растворов
Цель: закрепить
умения по использованию формул для нахождения молярной концентрации растворов
и массовой доли растворенного вещества
Ход
занятия.
1. Организационный
момент.
2. Актуализация
знаний: повторение формул используемых для решения
задач на нахождение концентрации и массовой доли вещества.
3. Выполнение
заданий практического занятия.
В методических
рекомендациях по выполнению практического занятия предложены 25 вариантов с
образцом решения задач.
4. Подведение
итогов.
Методические
рекомендации для выполнения практического занятия № 5
Решение
задач на вычисление концентрации растворов
Для получения
оценки удовлетворительно достаточно выполнить первые три задания; для получения
оценки хорошо необходимо выполнить четыре задания, для получения оценки отлично
необходимо выполнить пять заданий.
С –
молярная концентрация раствора.
Молярная
концентрация – это отношение количества растворенного
вещества к объему раствора
С = n
(вещества)/ V(раствора)
n
(вещества)= m(в-ва)/М(в-ва)
Пример 1 Рассчитайте
молярную концентрацию раствора (моль/л) раствора.
|
Дано: m (H2SO4)=14,5 V |
Решение: С = n n |
|
Найти: С (H2SO4)- ? |
1. М (H2SO4)= 2Ar(H)+Ar(S)+4Ar(О)=2*1+32+4*16=98г/моль 2. n (H2SO4)= n (H2SO4)=14,5/98=0,15 3. С (H2SO4)=0,15/0,5=0,3 Ответ: |
Задание №1:
Выполните по образцу задание своего варианта.
|
Вариант |
Формула |
Масса |
Объем |
|
1. |
KBrO3 |
12,4 |
0,3 |
|
2. |
KNO3 |
8,5 |
0,4 |
|
3. |
KReO4 |
18,1 |
0,75 |
|
4. |
K2Cr2O7 |
14,7 |
0,75 |
|
5. |
K2GeO3 |
6,3 |
0,65 |
|
6. |
KNCS |
23,9 |
0,8 |
|
7. |
Tl(NO3)3 |
0,91 |
0,25 |
|
8. |
Tl2CO3 |
0,93 |
0,05 |
|
9. |
Tl2SO4 |
54,27 |
5,46 |
|
10. |
ZnSO4 |
25,35 |
1,27 |
|
11. |
CoCl2 |
17,72 |
0,65 |
|
12. |
Fe(NO3)3 |
35,23 |
2,54 |
|
13. |
Cu(NO3)2 |
22,27 |
0,74 |
|
14. |
Fe2(SO4)3 |
44,58 |
3,08 |
|
15. |
Al2(SO4)3 |
6,54 |
0,2 |
|
16. |
TlNO3 |
1,92 |
0,15 |
|
17. |
CH3COONa |
3,03 |
0,1 |
|
18. |
Ca(ClO4)2 |
4,13 |
0,5 |
|
19. |
KAl(SO4)2 |
5,9 |
1,65 |
|
20. |
Na4B4O7 |
12,04 |
3,98 |
|
21. |
CuSO4 |
13,6 |
2,4 |
|
22. |
Na3PO4 |
15,9 |
0,65 |
|
23. |
Fe(NO3)3 |
23,4 |
3,67 |
|
24. |
KMnO4 |
34,9 |
1,45 |
|
25. |
Na2SO4 |
24,7 |
1,55 |
Пример №2 Рассчитайте
массовую долю (в %) гидроксида цезия в растворе массой 172 г, если масса
растворенной щелочи равна 8,6г.
|
Дано: m m (в-ва)=8,6 |
Решение: W= m |
|
Найти: w ( CsOH)- ? |
1. W=8,6/172=0,05; Ответ: W (H2SO4)= 5% |
Задание №2: Найдите массовую долю
вещества в данном растворе:
|
Вариант |
Формула |
Масса |
Масса |
|
1. |
KOH |
125 |
5 |
|
2. |
H2SO4 |
250 |
15 |
|
3. |
HNO3 |
300 |
25 |
|
4. |
CH3COOH |
200 |
38 |
|
5. |
HCl |
160 |
24 |
|
6. |
NaOH |
235 |
9 |
|
7. |
H3PO4 |
345 |
23 |
|
8. |
H2SO4 |
500 |
134 |
|
9. |
CuSO4 |
127 |
35 |
|
10. |
CuCl2 |
435 |
56 |
|
11. |
Na2SO4 |
238 |
125 |
|
12. |
K2SO4 |
250 |
38 |
|
13. |
BaCl2 |
200 |
40 |
|
14. |
AlCl3 |
190 |
45 |
|
15. |
NaCl |
150 |
50 |
|
16. |
CH3COOH |
145 |
14 |
|
17. |
H2SO4 |
400 |
8,5 |
|
18. |
H3PO4 |
200 |
9,7 |
|
19. |
AlCl3 |
150 |
8 |
|
20. |
Na2SO4 |
125 |
5,8 |
|
21. |
CuSO4 |
110 |
67 |
|
22. |
KOH |
230 |
45 |
|
23. |
NaOH |
180 |
50 |
|
24. |
CuCl2 |
165 |
65 |
|
25. |
BaCl2 |
170 |
70 |
Пример №3 Какая
масса серной кислоты, содержится в 400г 12%раствора?
|
Дано: m W (H2SO4)=12%; |
Решение: W= m m |
|
Найти: m (H2SO4)=? |
1. m (H2SO4)= Ответ: m (H2SO4)= 48г |
Задание
№3: Найдите массу вещества в данном растворе:
|
Вариант |
Задание |
|
1. |
Какую |
|
2. |
Сколько |
|
3. |
Какая |
|
4. |
Какая |
|
5. |
Какую |
|
6. |
Какая |
|
7. |
Какая |
|
8. |
Какая |
|
9. |
Какая |
|
10. |
Какая |
|
11. |
Какая |
|
12. |
Какая |
|
13. |
Какая |
|
14. |
Какую |
|
15. |
Какую |
|
16. |
Какую |
|
17. |
Какую |
|
18. |
Какую |
|
19. |
Какую |
|
20. |
Какую |
|
21. |
Какая |
|
22. |
Какая |
|
23. |
Какая |
|
24. |
Какая масса |
|
25. |
Какая |
Пример №4 Смешали
600г 20%-ного и 750г 40%-ного раствора нитрата аммония. Какова массовая доля
соли в полученном растворе?
|
Дано: m1 (р—ра)=600г. W1 m2 (р—ра)=750г. W2 |
Решение: W= m W3 (NH4NO3 )= m |
|
Найти: W3 |
1. m1 (NH4NO3)= m2 (NH4NO3)= 2. W3 Ответ: W3 |
Задание № 4 Рассчитайте
массовую долю в растворе при смешивании двух растворов с разной массовой долей
вещества.
|
Вариант |
Масса (m1 (р-ра)) |
Массовая |
Масса (m2 (р-ра)) |
Массовая |
|
1. |
100 |
20 |
50 |
32 |
|
2. |
120 |
15 |
60 |
12 |
|
3. |
110 |
5 |
80 |
15 |
|
4. |
115 |
8 |
90 |
10 |
|
5. |
60 |
10 |
50 |
5 |
|
6. |
75 |
12 |
125 |
20 |
|
7. |
87 |
15 |
300 |
25 |
|
8. |
90 |
17 |
250 |
15 |
|
9. |
45 |
6 |
120 |
30 |
|
10. |
56 |
5 |
100 |
10 |
|
11. |
100 |
35 |
240 |
5 |
|
12. |
150 |
2 |
250 |
25 |
|
13. |
400 |
20 |
150 |
18 |
|
14. |
350 |
25 |
160 |
15 |
|
15. |
200 |
12 |
80 |
5 |
|
16. |
190 |
15 |
30 |
2 |
|
17. |
180 |
15 |
120 |
12 |
|
18. |
125 |
50 |
125 |
10 |
|
19. |
130 |
32 |
400 |
15 |
|
20. |
145 |
22 |
300 |
12 |
|
21. |
155 |
3 |
250 |
25 |
|
22. |
160 |
9 |
140 |
30 |
|
23. |
180 |
10 |
240 |
50 |
|
24. |
190 |
15 |
130 |
23 |
|
25. |
210 |
16 |
140 |
10 |
Задание повышенной
сложности
Задание
№5: Проведите необходимые вычисления.
Формулы
необходимые для вычисления:
W=
m
(вещества)/ m(раствора)
m
(вещества)= W×m(раствора)
m(раствора)
= ᴠ×ρ
С=ν/ᴠ
m( Н2О) = m(раствора)
— m
(вещества)
|
вариант |
Формула растворенного вещества |
Масса растворенного вещества m(в-ва), г |
Масса раствора m(р-ра), г |
Масса воды m(H2O) |
Массовая доля вещества ω,% |
Молярная концентрация раствора, |
Число молей растворенного , моль |
Плотность раствора ρ,г/мл |
|
1. |
NaCl |
400 |
10 |
1,0 |
||||
|
2. |
LiBr |
110 |
0,2 |
1,0 |
||||
|
3. |
NH4F |
15 |
55 |
1,01 |
||||
|
4. |
KF |
100 |
2 |
1,0 |
||||
|
5. |
Na2SO4 |
200 |
0,4 |
1,0 |
||||
|
6. |
BaCl2 |
10 |
120 |
1,0 |
||||
|
7. |
KNO3 |
1050 |
50 |
1,0 |
||||
|
8. |
MgCl2 |
300 |
1,2 |
1,01 |
||||
|
9. |
NaNO3 |
25 |
105 |
1,01 |
||||
|
10. |
LiCl |
60 |
0,5 |
1,01 |
||||
|
11. |
NH4NO3 |
600 |
2,5 |
1,0 |
||||
|
12. |
CrCl3 |
50 |
200 |
1,0 |
||||
|
13. |
FeCl3 |
170 |
430 |
1,0 |
||||
|
14. |
FeBr2 |
360 |
2,4 |
1,12 |
||||
|
15. |
NaOH |
620 |
50 |
1,11 |
||||
|
16. |
LiOH |
240 |
35 |
1,2 |
||||
|
17. |
HNO3 |
150 |
2 |
1,3 |
||||
|
18. |
HCl |
400 |
10 |
1,01 |
||||
|
19. |
H2SO4 |
50 |
100 |
1,35 |
||||
|
20. |
HBr |
250 |
5 |
1,01 |
||||
|
21. |
KOH |
120 |
25 |
1,2 |
||||
|
22. |
AlCl3 |
200 |
2 |
1,0 |
||||
|
23. |
Ba(NO3)2 |
130 |
270 |
1,0 |
||||
|
24. |
CH3COOH |
30 |
2 |
1,1 |
||||
|
25. |
H2SO4 |
500 |
400 |
1,15 |
Download Article
Download Article
In chemistry, a solution’s concentration is how much of a dissolvable substance, known as a solute, is mixed with another substance, called the solvent. The standard formula is C = m/V, where C is the concentration, m is the mass of the solute dissolved, and V is the total volume of the solution. If you have a small concentration, find the answer in parts per million (ppm) to make it easier to follow. In a lab setting, you may be asked to find the molarity, or molar concentration, of the solution instead.
-
1
Find the mass of the solute mixed in with the solvent. The solute is the substance that you’re mixing in to form your solution. If you’re given the mass of the solute in your problem, write it down and be sure to label it with the correct units. If you need to find the mass of the solute, then weigh it on a lab scale and record the measurement.[1]
- If the solute you’re using is a liquid, then you can also calculate the mass using the density formula, where density D = m/V, where m is the mass of the liquid and V is the volume. To find the mass, multiply the density of the liquid by the volume.
Tip: If you need to use a scale, subtract the mass of the container you’re using to hold the solute or else your calculations will be off.
-
2
Record the total volume of the solution. The total volume of the solution is the amount of solvent plus the amount of solute added to it. If you’re finding the volume in a lab, mix the solution in a graduated cylinder or beaker and look at the measurement. Measure the volume from the curve at the top of the solution, or the meniscus, to get the most accurate reading. Record the volume of the solution.[2]
- If you aren’t measuring the volume yourself, you may need to convert the mass of the solute into volume using the density formula.
- For example, if you’re finding the concentration of 3.45 grams of salt in 2 liters of water, you would find the volume of salt using the density formula. Look up the density of salt either in a textbook or online and solve the formula for m. In this case, the density of salt is 2.16 g/mL. The formula would read 2.16 g/mL = (3.45 g)/V. Multiply each side by V to get V(2.16 g/mL) = 3.45 g. Then divide the each side by 2.16 to find the volume, or V = (3.45 g)/(2.16 g/mL) = 1.60 mL.
- Add the volume of the solute to the volume of your solvent, ma. So in this example, 2 L + 1.6 mL = 2,000 mL + 1.6 mL = 2,001.6 mL. You can either leave the measurement in milliliters or convert it back to liters to get 2.002 L.
Advertisement
-
3
Divide the mass of the solute by the total volume of the solution. Write out the equation C = m/V, where m is the mass of the solute and V is the total volume of the solution. Plug in the values you found for the mass and volume, and divide them to find the concentration of your solution. Don’t forget to label to label your answer with the correct units.[3]
- In our example for the concentration of 3.45 grams of salt in 2 liters of water, your equation would be C = (3.45 g)/(2.002 L) = 1.723 g/L.
- Certain problems may ask for your concentration in specific units. Be sure to convert the units before putting them in your final formula.
Advertisement
-
1
Find the mass of the solute in grams. Measure out the mass of the solute that you plan on mixing with your solution. Be sure to subtract the weight of the container you’re using to measure the solute or else your concentration will be inaccurate.[4]
- If your solute is a liquid, you may need to calculate the mass using the formula D = m/V, where D is the liquid’s density, m is the mass, and V is the volume. Look up the density of the liquid in a textbook or online and then solve the equation for the mass.
-
2
Determine the total mass of the solution in grams. The total mass of the solution is the mass of the solvent plus the mass of the solute. Weight the masses using a lab scale or convert the volume of the solvent to mass by using the density formula D = m/V. Add the mass of the solute to the mass of the solvent to find your final volume.[5]
- For example, if you want to find the concentration of 10 g of cocoa powder mixed with 1.2 L of water, you would find the mass of the water using the density formula. The density of water is 1,000 g/L, so your equation would read 1,000 g/L = m/(1.2 L). Multiply each side by 1.2 L to solve the mass in grams, so m = (1.2 L)(1,000 g/L) = 1,200 g. Add the mass of the cocoa powder to get 1,210 g.
-
3
Divide the mass of the solute by the total mass of the solution. Set up your equation so the concentration C = mass of the solute/total mass of the solution. Plug in your values and solve the equation to find the concentration of your solution.[6]
- In our example, C = (10 g)/(1,210 g) = 0.00826.
-
4
Multiply your answer by 100 if you want to find the percent concentration. If you’re asked to list the concentration in a percentage, take the answer you just found and multiply it by 100. Label your final answer with a percentage sign.[7]
- In this example, the percent concentration is (0.00826)(100) = 0.826%.
-
5
Multiply the concentration by 1,000,000 to find the parts per million. Use the number you found for your concentration and multiply it by 1,000,000 or 106. The number will be how many parts per million the solute is. Label your final answer in ppm.[8]
- In our example, the ppm = (0.00826)(1,000,000) = 8,260 ppm.
Tip: Parts per million is usually used for very small concentrations since it’s easier to write and understand than a percentage.
Advertisement
-
1
Add the atomic masses of the solute together to find the molar mass. Look at the elements in the chemical formula for the solute you’re using. List the atomic mass for each element in the solute since atomic and molar mass are the same. Add together the atomic masses from your solute to find the total molar mass. Label the final measurement in g/mol.[9]
- For example, if your solute is potassium hydroxide (KOH), find the atomic masses for potassium, oxygen, and hydrogen and add them together. In this case molar mass = 39 +16 + 1 = 56 g/mol.
- Molarity is used mainly in chemistry when you know the chemical makeup of the solute you’re using.
-
2
Divide the mass of the solute by the molar mass to find the number of moles. Find the mass of the solute you’re adding into your solution using a lab scale if you need to.[10]
Be sure to subtract the mass of the container so you have an accurate reading. Divide the mass you found by the molar mass so you can find how many moles of the solute you’re using. Label your answer with “mol.”[11]
- For example, if you want to find the number of moles in 25 g of potassium hydroxide (KOH), then the equation is mol = (25 g)/(56 g/mol) = 0.45 mol
- Convert the mass of your solute to grams if it isn’t already listed in grams.
- Moles are used to represent the number of atoms in the solution.
-
3
Convert the volume of the solution to liters. Find the volume of the solvent before you mix in the solute.[12]
Use a flask or a graduated cylinder to find the measurement if you aren’t given it. If your measurement is in milliliters, then divide it by 1,000 to convert it to liters.[13]
- In this example, if you’re using 400 mL of water, then divide it by 1,000 to convert it to liters, which is 0.4 L.
- If your solvent is already listed in liters, then you can skip this step.
Tip: You don’t need to include the volume of the solute since it doesn’t usually affect the volume that much. If there is a visible change in volume when you mix the solute with the solvent, then use the total volume instead.
-
4
Divide the moles of solute by the volume of the solution in liters. Set up your equation so the molarity M = mol/V, where mol is the number of moles of the solute and V is the volume of the solvent. Solve the equation and label the answer M.[14]
[15]
- In this example, M = (0.45 mol)/(0.4 L) = 1.125 M.
Advertisement
Calculator, Practice Problems, and Answers
Add New Question
-
Question
How do I convert milligrams to moles?
First, calculate the molar mass of your substance. (Add the atomic masses of the constituent elements.) Then, convert milligrams to grams by dividing by 1000. Finally, divide the grams of your substance by the Molar Mass.
-
Question
If I have a solution with unknown mass, how do I calculate concentration?
Calculate the number of moles using the equation c=n/v for the first given solution.Then using the no of moles calculate the mass using equation n=m/Mr.
-
Question
If I am given two solutions, what is one way of knowing which one is more/less concentrated?
You can perform titrations. Under the Le Chatelier’s principle, the more concentrated one will have faster reacting time due to the fact that the more concentrated one has more molecules of that substance, leading to the ultimate truth that the chances of molecules meeting each other is bigger. Note that this method will not work if you are dropping Transition Metals into room-temperature, concentrated HNO3 or H2SO4 since Iron (and other metals) has the property called passivation. It happens when the metal reacts w/ the acid so quickly that the metal forms a salt, preventing the further reaction to the acid.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
If you are in a lab and don’t know how much of a solute was added, you can perform a titration test using other reactive chemicals. You do need to learn how to balance chemical equations with stoichiometry.
Advertisement
About This Article
Article SummaryX
To calculate the concentration of a solution, start by converting the solute, or the substance being dissolved, into grams. If you’re converting from milliliters, you may need to look up the solute’s density and then multiply that by the volume to convert to grams. Next, convert the solvent to liters. Finally, divide the solvent by the solute to find the concentration of the solution. To learn how to calculate the concentration of a solution as a percentage or parts per million, scroll down!
Did this summary help you?
Thanks to all authors for creating a page that has been read 1,978,525 times.
Did this article help you?
Формула концентрации раствора. Их множество. И каждая соответствует тому или иному способу выражения концентрации. А в химии их применяются достаточно: массовая доля растворенного вещества, молярная, нормальная, моляльная, титр и др.
Зачем так много? Ответ на этот вопрос очень прост. Каждый вид концентрации удобен в том или ином случае, когда применение другого вида концентрации неуместно.
Например, при исследовании содержания массы вещества в очень небольшом объеме раствора удобно пользоваться титром. А в каких-то технологиях вообще концентрация заменяется другими количественными характеристиками раствора. Так, в технологии посола рыбы для расчета необходимой концентрации тузлука (раствора поваренной соли) используют не его процентную концентрацию, а плотность.
Содержание:
1. Концентрация – что это такое
2. Формула концентрации раствора: основные виды
3. Массовая доля растворенного вещества и примеры ее вычисления
- разбавление раствора водой
- концентрирование раствора путем упаривания
- концентрирование раствора путем добавления растворенного вещества
- смешивание двух растворов
- применение кристаллогидратов для приготовления раствора (задачи на кристаллогидраты)
4. Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Концентрация – что это такое
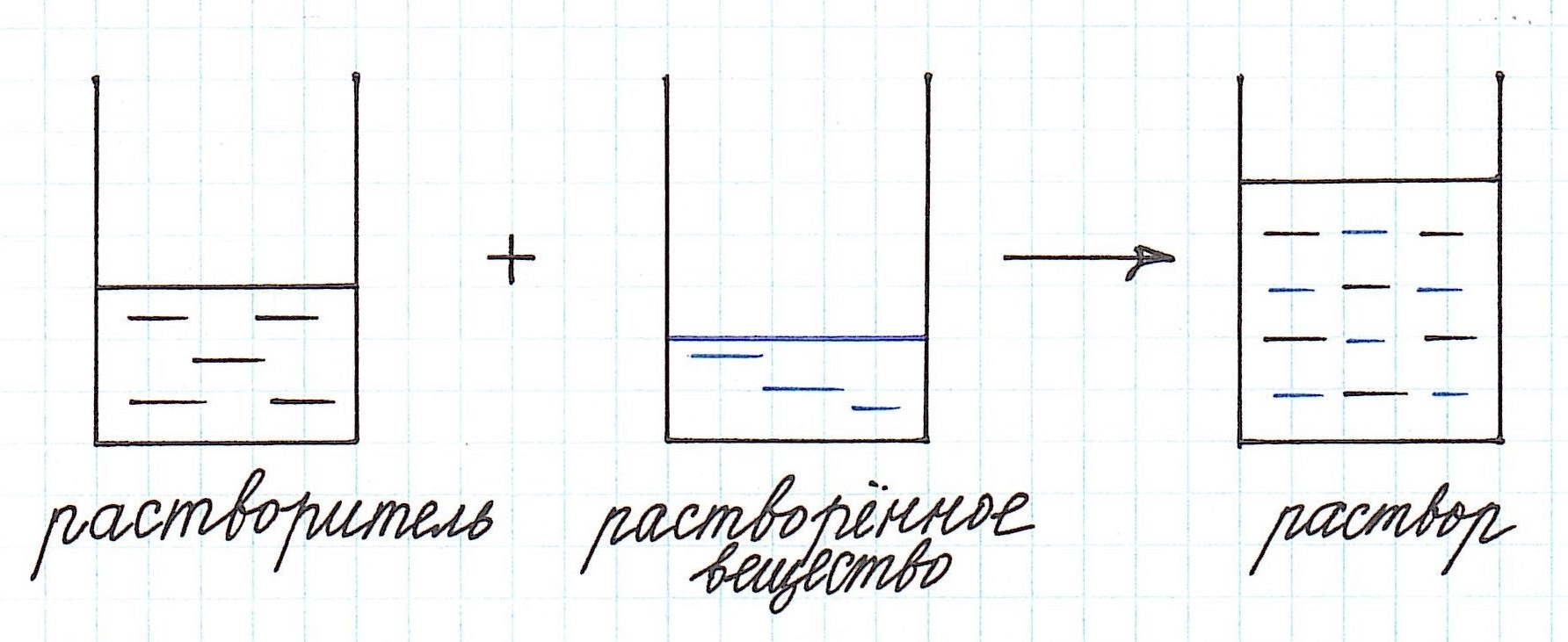
Любой раствор имеет различные характеристики: качественные и количественные. Одной из важнейших количественных характеристик является концентрация раствора.
Концентрация раствора – это количество растворенного вещества, содержащееся в определенном количестве раствора.
Как видно из приведенного определения, основными компонентами раствора являются:
— растворитель;
— растворенное вещество.
Растворенного вещества в растворе всегда меньше, а растворителя больше.
И вот именно с вычислением количественного содержания растворенного вещества чаще всего и связаны все расчеты, основанные на применении формулы концентрации раствора.
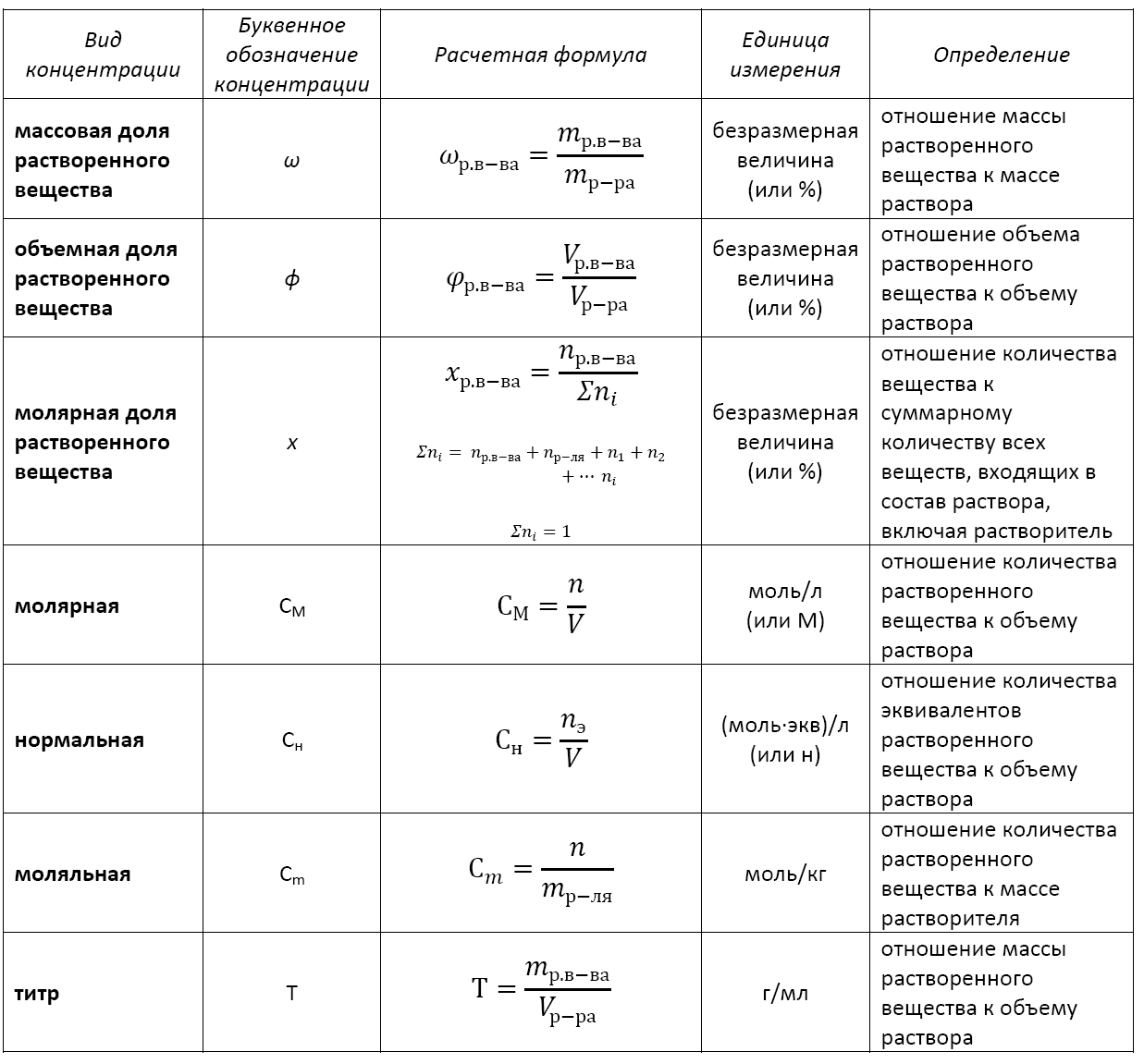
Существует несколько видов концентрации раствора:
— массовая доля растворенного вещества;
— объемная доля растворенного вещества;
— молярная доля растворенного вещества;
— молярная (или молярность);
— моляльная (или моляльность);
— нормальная (или эквивалентная);
— титр.
Формула концентрации раствора: основные виды
Применение того или иного вида концентрации уместно в каждом конкретном случае. Не существует какой-то универсальной концентрации или универсальной формулы концентрации раствора.
Кстати, с помощью математических преобразований можно перейти от одной концентрации к другой или найти взаимосвязь между разными их видами.
Основные расчетные формулы концентрации раствора приведены в таблице:
Массовая доля растворенного вещества и примеры ее вычисления
Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора.
Ее расчетная формула выглядит так:
где ωр.в-ва – массовая доля растворенного вещества, mр.в-ва – масса растворенного вещества, mр-ра – масса раствора.
ωр.в-ва представляет собой долю или от единицы или от 100%. Так, например, имеется двухпроцентный раствор NaCl. Его концентрация будет записана в первом случае ω(NaCl) = 0,02, а во втором – ω(NaCl) = 2%. Форма записи основной сути не меняет. Можно записывать и так, и так.
Что же означает выражение ω(NaCl) = 0,02 или ω(NaCl) = 2%? Буквально следующее: в 100 г водного раствора поваренной соли содержится 2 г этой соли и 98 г воды.
Необходимо помнить, что раствор состоит из растворителя и растворенного вещества. Поэтому масса раствора будет состоять из массы растворителя и массы растворенного вещества:
Тогда основную расчетную формулу для массовой доли растворенного вещества можно преобразовать:
Очень часто в расчетах с процентной концентрацией используются плотность и объем раствора:
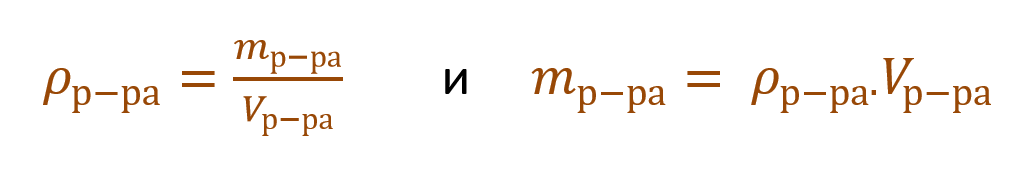
В других ситуациях могут использоваться объем и плотность не раствора, а растворителя. Тогда основная формула для расчета концентрации будет выглядеть так:
На практике бывает необходимо не только приготовить раствор с какой-либо определенной концентрацией, но и увеличить, либо уменьшить ее значение. Это достигается различными приемами:
— упариванием раствора;
— добавлением растворенного вещества;
— добавлением к раствору растворителя (например, воды).
Кроме того, приходится часто смешивать друг с другом растворы разных концентраций.
Разберем все возможные случаи.
Мы рекомендуем задачи, в которых речь идет о растворах, решать с использованием схематических рисунков. Это очень наглядно, особенно, когда речь идет о смешивании растворов.
Начнем с самого простого: вычислим концентрацию раствора.
Пример 1. В 200 г воды растворили 40 г глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
Обратите внимание, что речи о каком-либо химическом взаимодействии не идет! Поэтому записывать уравнения реакций не требуется!
Запишем общую формулу для расчета массовой доли растворенного вещества:
В данной задаче глюкоза (C6H12O6) – растворенное вещество, а вода (H2O) – растворитель. Масса раствора будет складываться из массы глюкозы и массы воды:
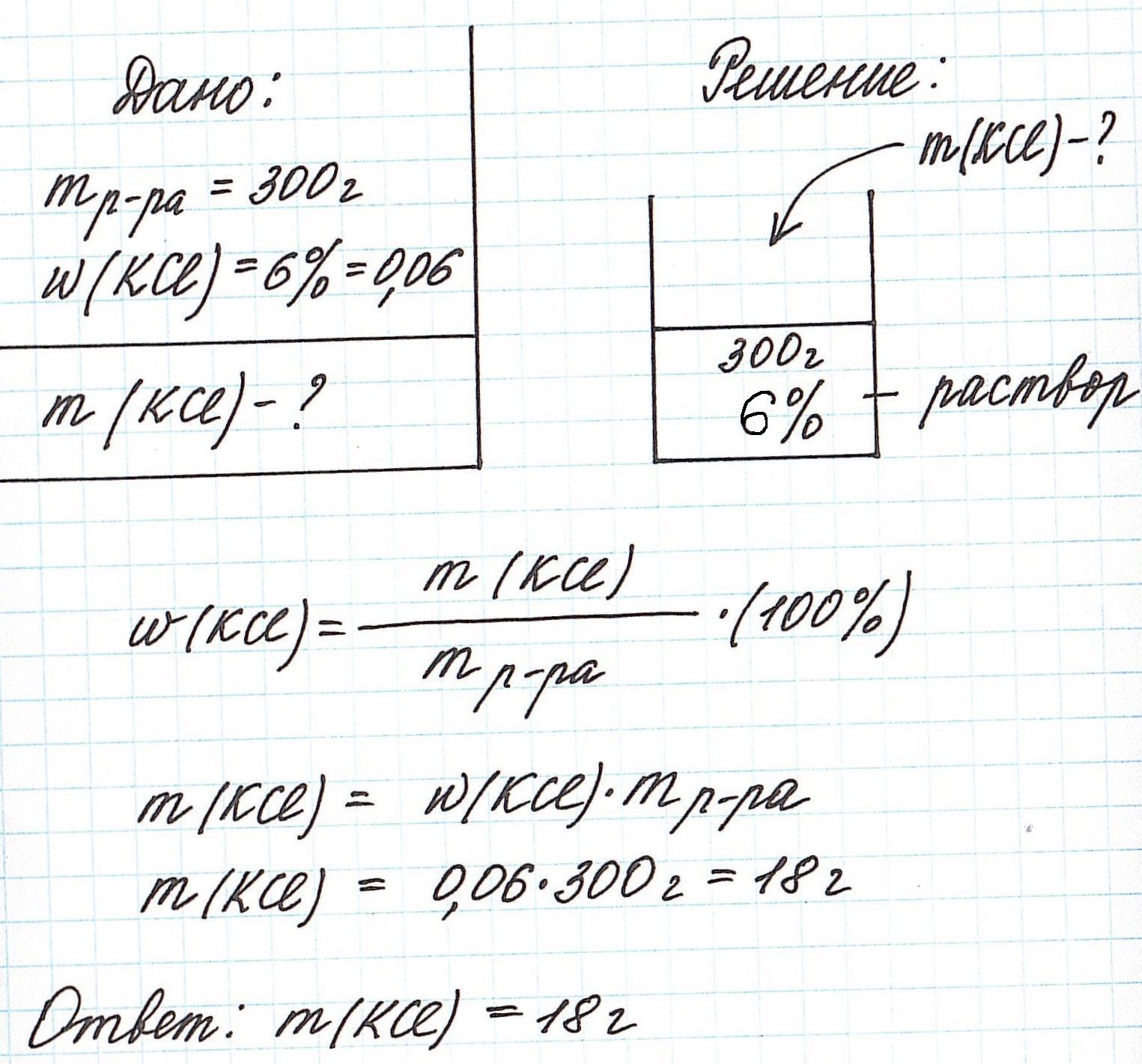
Пример 2. Рассчитайте, сколько потребуется хлорида калия, чтобы приготовить 300 г раствора с массовой долей соли 6%.
Обратите внимание, для того, чтобы расчеты были менее громоздкими, будем использовать выражение концентрации не в %, а в долях от единицы.
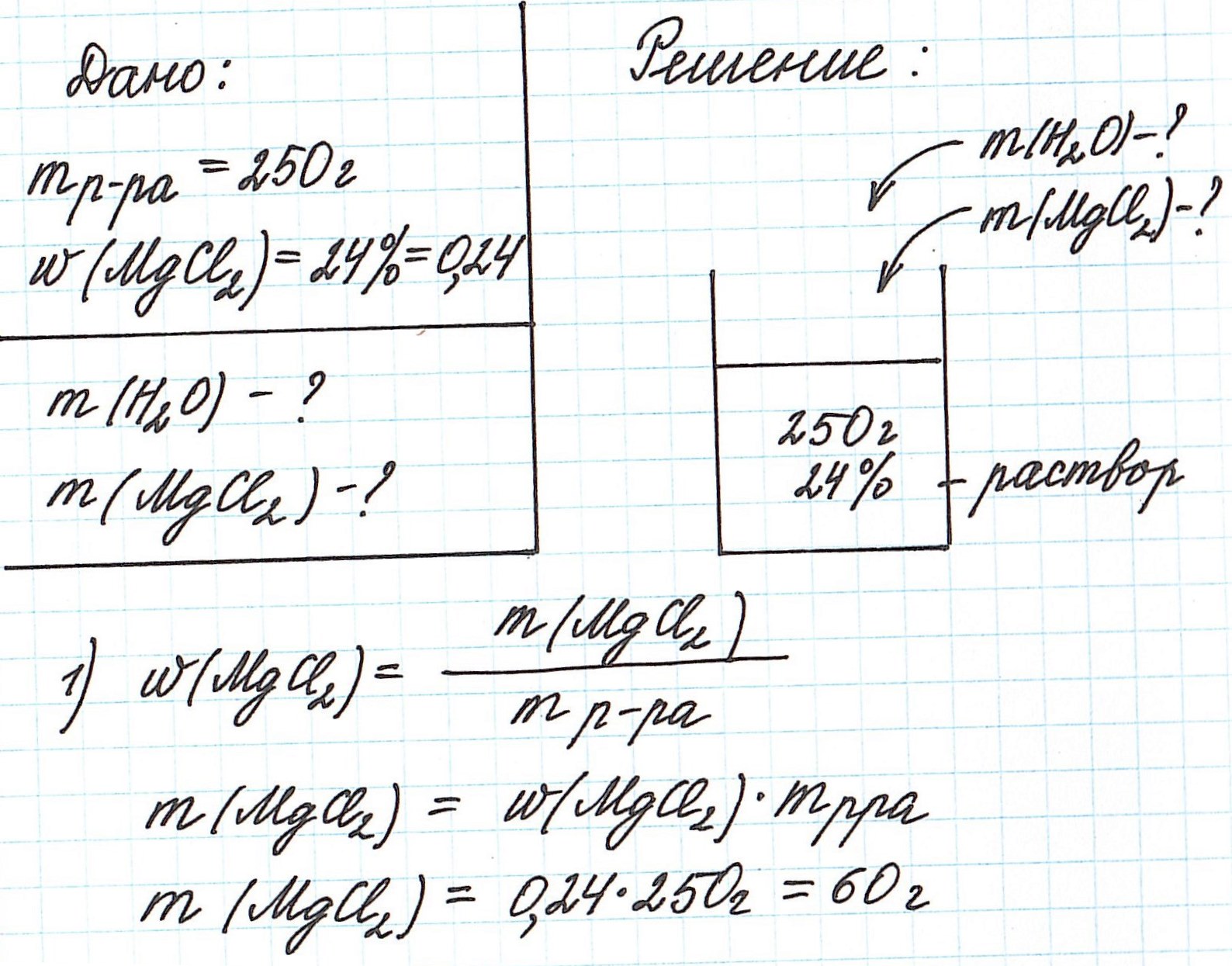
Пример 3. Необходимо приготовить 250 г раствора с массовой долей хлорида магния 24%. Рассчитайте массу требуемых воды и соли.
Так как раствор готовится из хлорида магния и воды, то и масса раствора равна сумме масс хлорида магния и воды:
Рассмотрим задачу, в которой в качестве растворителя выступает не вода, а другое вещество.
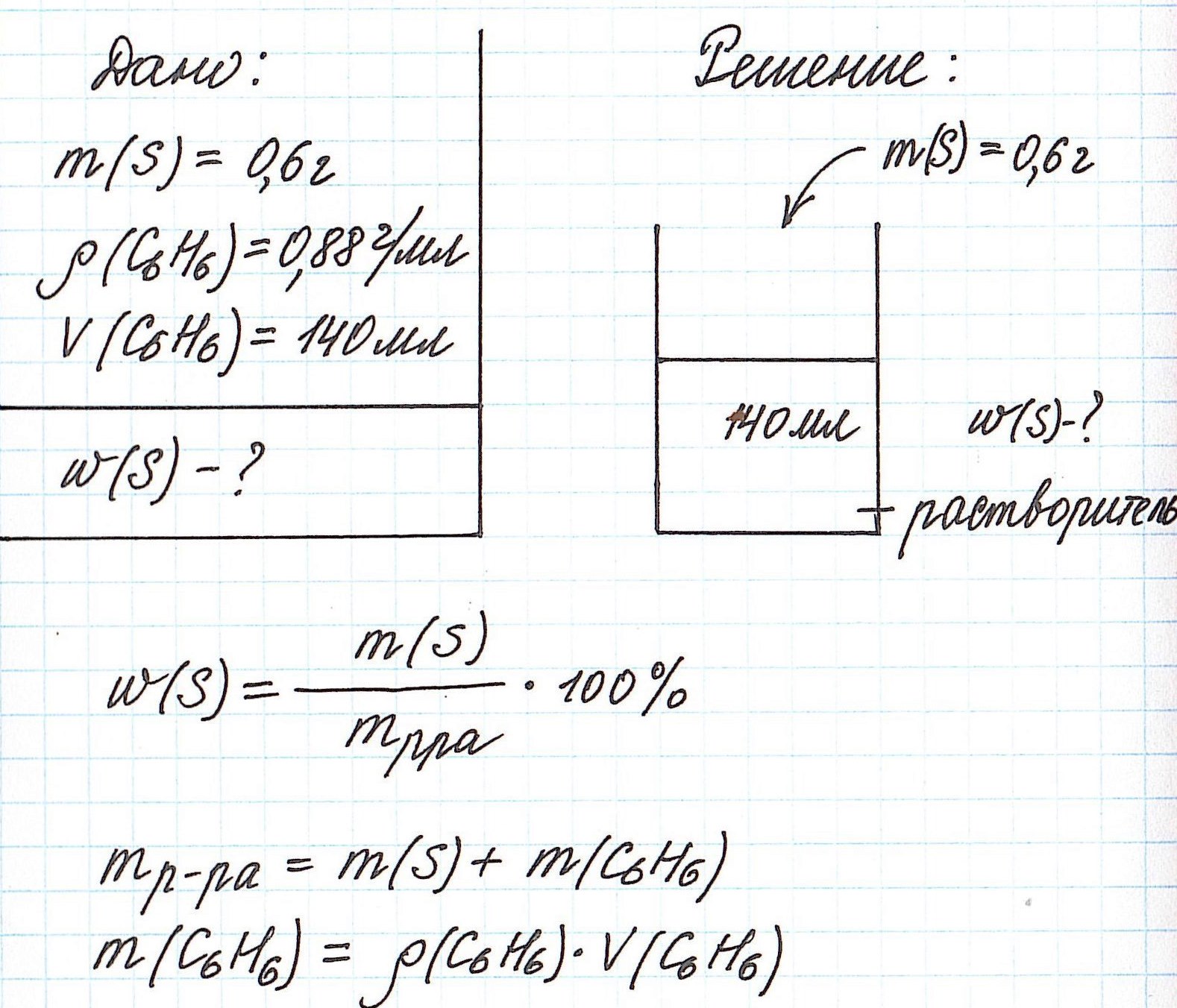
Пример 4. В органическом растворителе бензоле объемом 140 мл растворили серу массой 0,6 г. Вычислите массовую долю серы в полученном растворе, если плотность бензола составляет 0,88 г/мл.
Обратите внимание, что здесь:
— масса раствора не известна;
— масса растворителя (бензола) не известна;
— известны объем и плотность растворителя (бензола), что позволяет нам найти его массу;
— масса раствора состоит из массы растворителя (бензол) и массы растворенного вещества (сера).
Объединим все расчетные формулы в одну и подставим в нее имеющиеся численные значения:
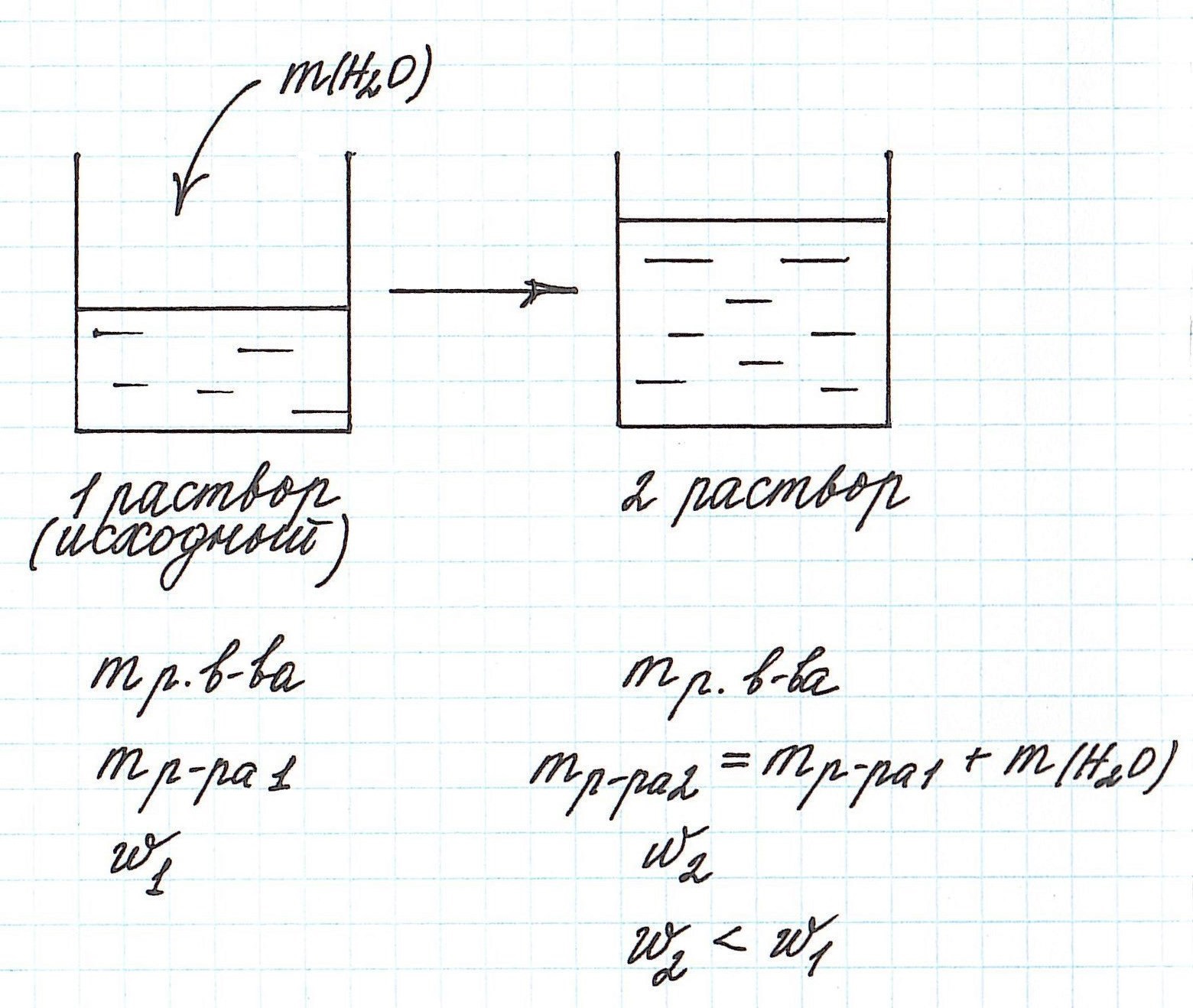
Вычисление массовой доли растворенного вещества при разбавлении раствора водой
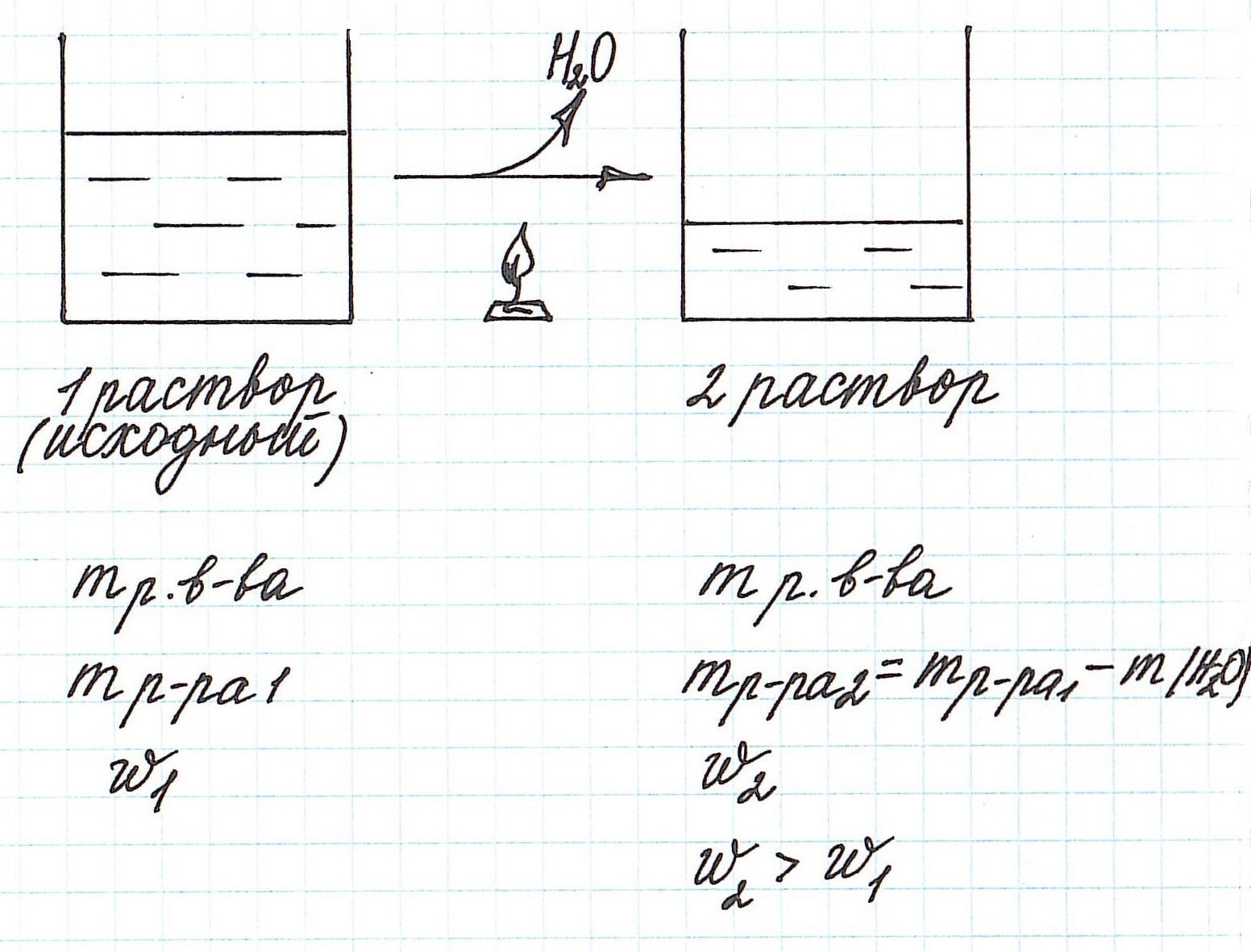
Разбавление раствора водой приводит к уменьшению его концентрации.
Запомним, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворителя;
— масса растворенного вещества остается постоянной.
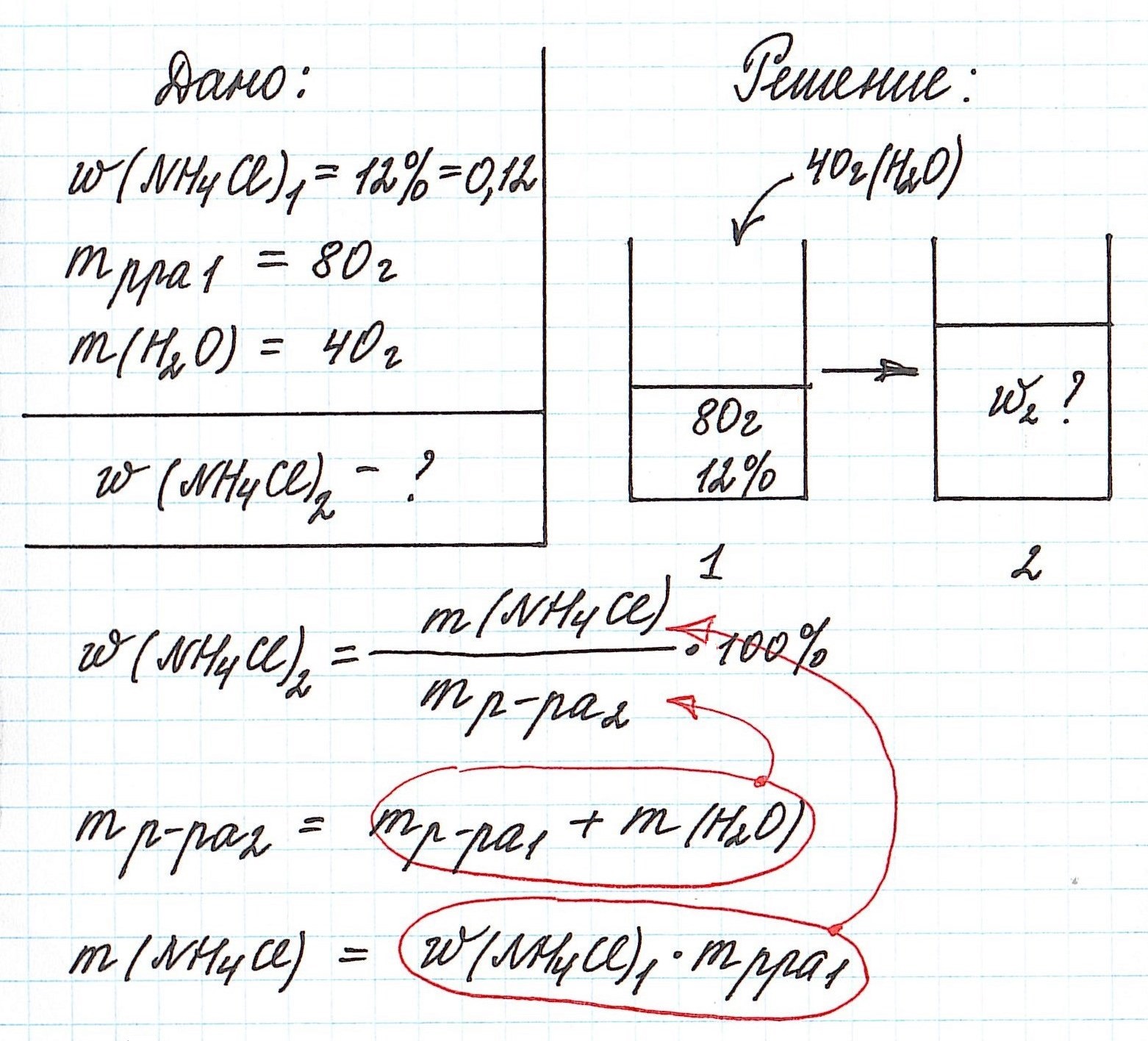
Пример 5. К 80 г раствора с массовой долей NH4Cl 12% добавили 40 г воды. Вычислите массовую долю хлорида аммония в полученном растворе.
Объединим все полученные формулы в одну и подставим имеющиеся данные:
Пример 6. Рассчитайте объем раствора фосфорной кислоты (массовая доля кислоты 12%, плотность 1,065 г/мл), который потребуется для приготовления раствора с массовой долей H3РO4 4% объемом 250 мл (плотность 1,02 г/мл).
В данной задаче речь напрямую о разбавлении раствора не идет. Но судя по тому, что исходный раствор имел концентрацию 12%, а конечный – 4%, становится ясно: последний раствор можно получить путем разбавления первого водой.
Вычисление массовой доли растворенного вещества при концентрировании раствора путем упаривания
Упаривание раствора, т.е. его нагревание, при котором происходит испарение воды, приводит к увеличению концентрации.
Учтите, что при этом:
— уменьшается масса раствора;
— уменьшается масса растворителя;
— масса растворенного вещества остается постоянной (при условии, что растворенное вещество не разлагается при данной температуре).
Пример 7. Из 200 г 27%-ного раствора глюкозы выпарили 20 г воды. Определите массовую долю глюкозы в полученном растворе.
Вычисление массовой доли растворенного вещества при концентрировании раствора путем добавления растворенного вещества
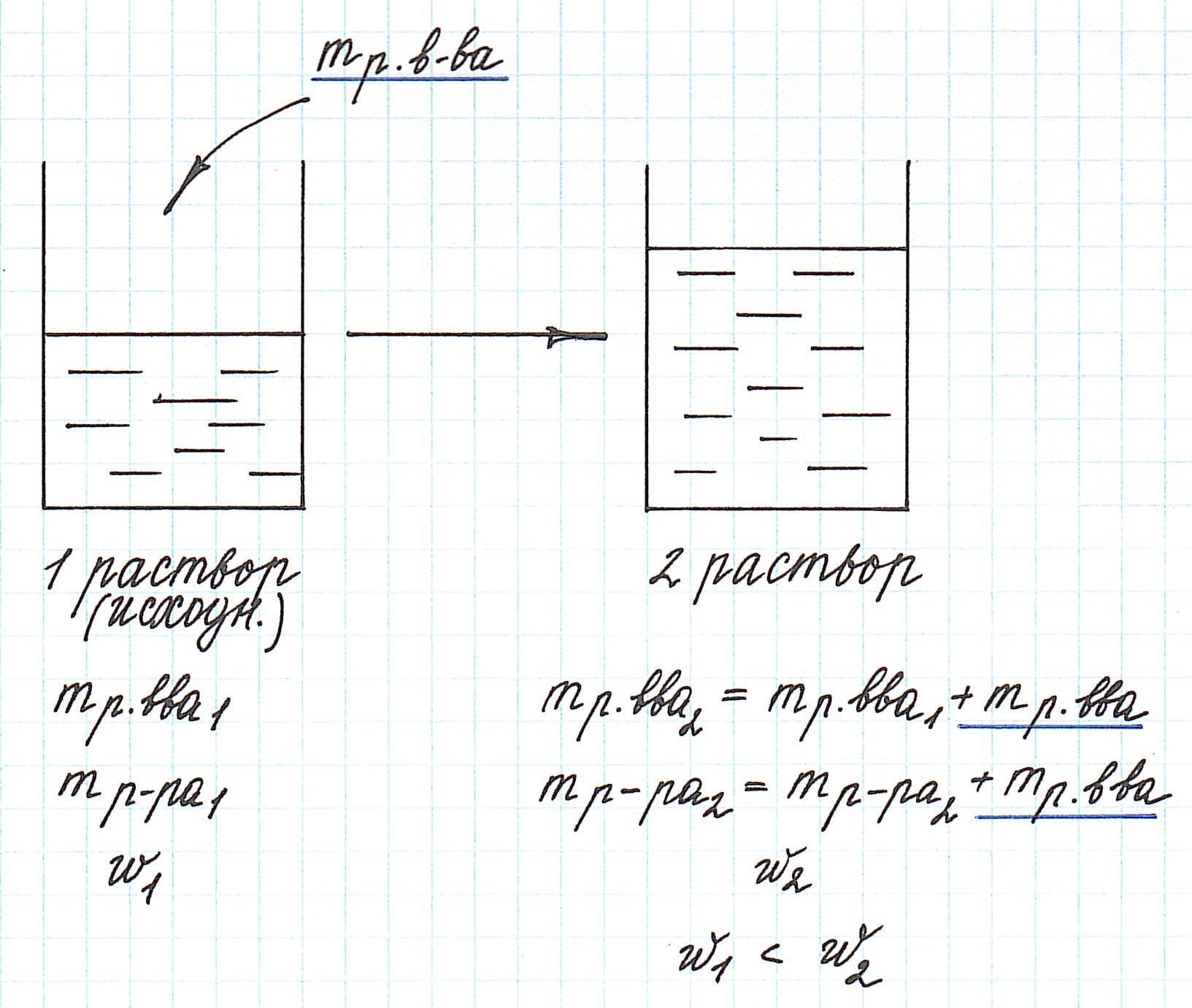
Добавление к уже существующему раствору новой порции растворенного вещества приводит к увеличению концентрации раствора.
Помните, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества.
Пример 8. Определите массу хлорида калия, который надо добавить к 180 г 15%-ного раствора этой соли, чтобы получить 20%-ный раствор.
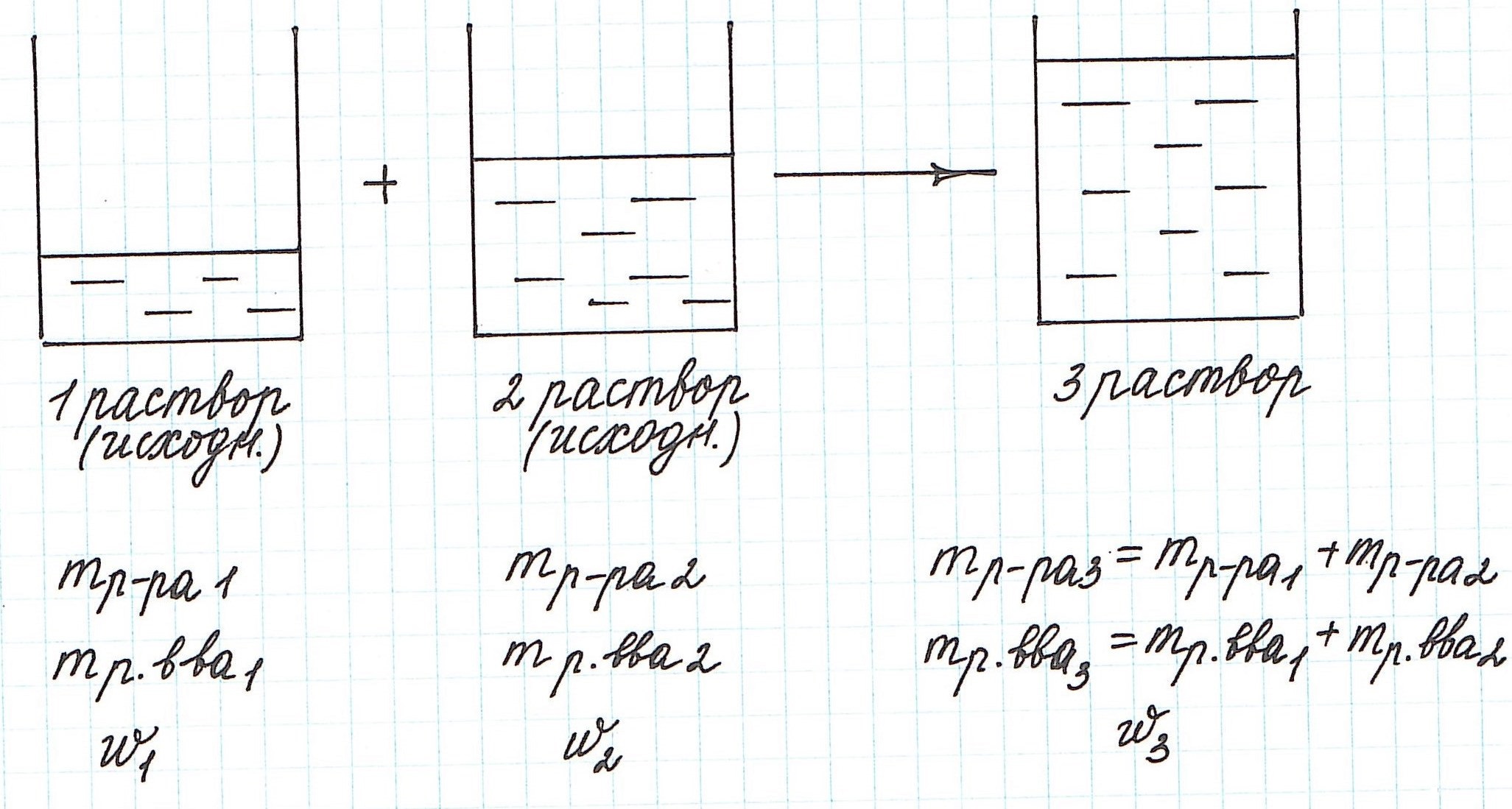
Вычисление массовой доли растворенного вещества при смешивании двух растворов
При смешивании двух растворов (речь о растворах одного и того же вещества конечно же) изменяются все количественные характеристики:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества;
— изменяется массовая доля растворенного вещества.
Пример 9. Смешали 80 г 32%-ного раствора и 30 г 10%-ного раствора нитрата меди (II). Какова концентрация соли в полученном растворе?
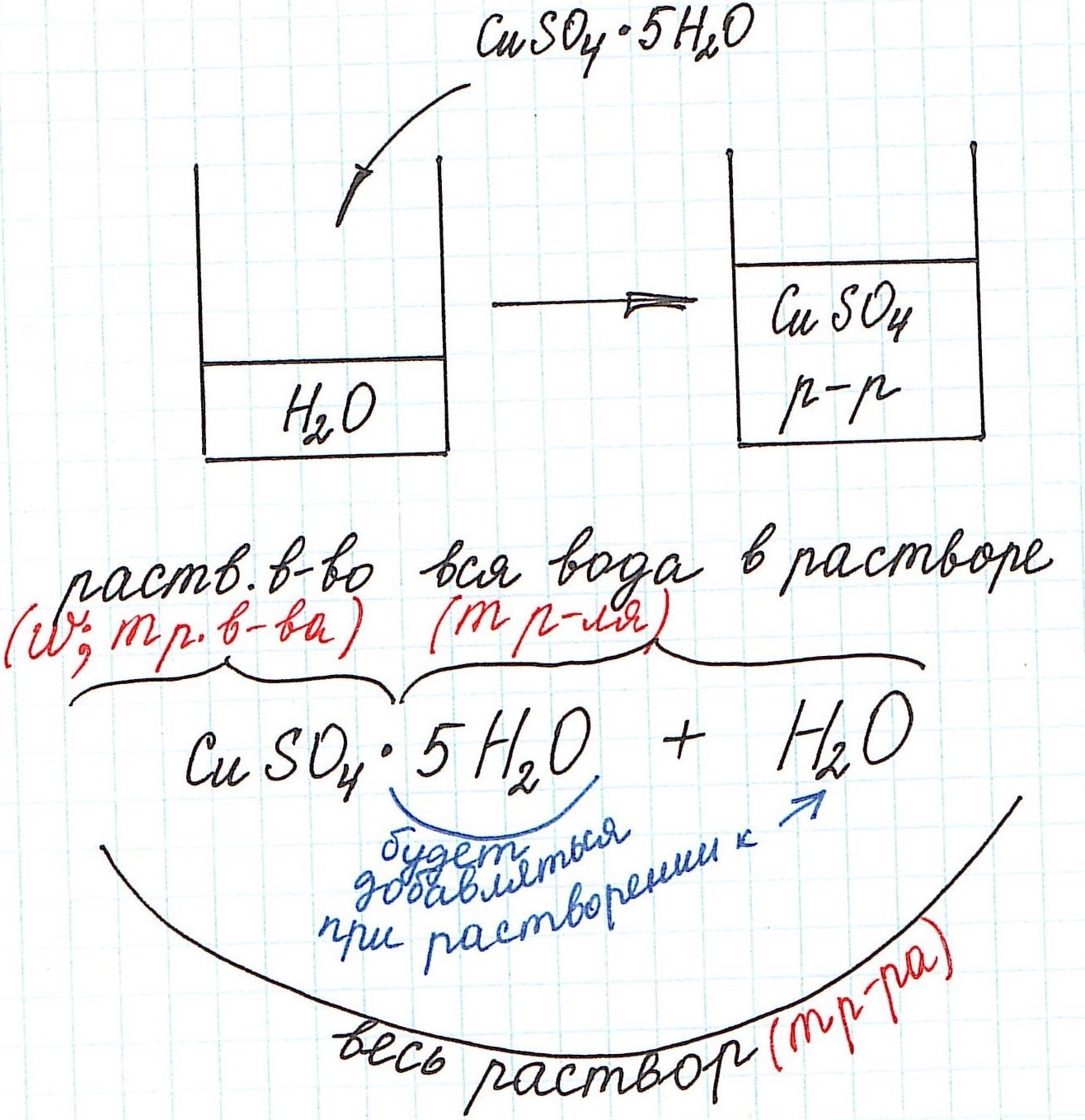
Вычисление массовой доли растворенного вещества с применением кристаллогидратов для приготовления раствора
Кристаллогидраты используются для приготовления растворов довольно часто. Кристаллогидраты представляют собой вещества, в состав которых помимо основного вещества входят молекулы воды. Например:
CuSO4·5H2O – кристаллогидрат сульфата меди (II) (или медный купорос);
Na2SO4·10H2O – кристаллогидрат сульфата натрия (или глауберова соль).
Больше примеров здесь.
Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Кристаллогидраты различаются прочностью связи между основным веществом и кристаллизационной водой. Одни из них теряют воду при комнатной температуре с течением времени и перестают быть кристаллогидратами (например, Na2СO3·10H2O). Другие – обезвоживаются только при сильном нагревании (например, CuSO4·5H2O).
При расчете концентрации с использованием кристаллогидратов для получения растворов часто приходится учитывать и кристаллизационную воду.
Но сначала поясним некоторые нюансы на конкретном примере:
1) Формула CuSO4·5H2O означает, что 1 моль CuSO4·5H2O содержит 1 моль CuSO4 и 5 моль H2O. Это можно было бы записать так:
n(CuSO4) = n(CuSO4·5H2O); n(H2O) = 5n(CuSO4·5H2O)
2) Относительная молекулярная (и численно молярная) масса будет складываться из относительной молекулярной массы вещества и относительной молекулярной массы воды. Например:
Mr(CuSO4·5H2O) = Mr(CuSO4) + 5·Mr(H2O) = 160 + 5·18 = 250 и, соответственно,
M(CuSO4·5H2O) = M(CuSO4) + 5·M(H2O) = 160 + 5·18 = 250 г/моль.
3) Еще одну особенность поясним с помощью рисунка:
Итак, разберем несколько типичных задач.
Пример 10. В 60 г воды растворили глауберову соль Na2SO4·10H2O массой 5,6 г. Какова массовая доля сульфата натрия в полученном растворе?
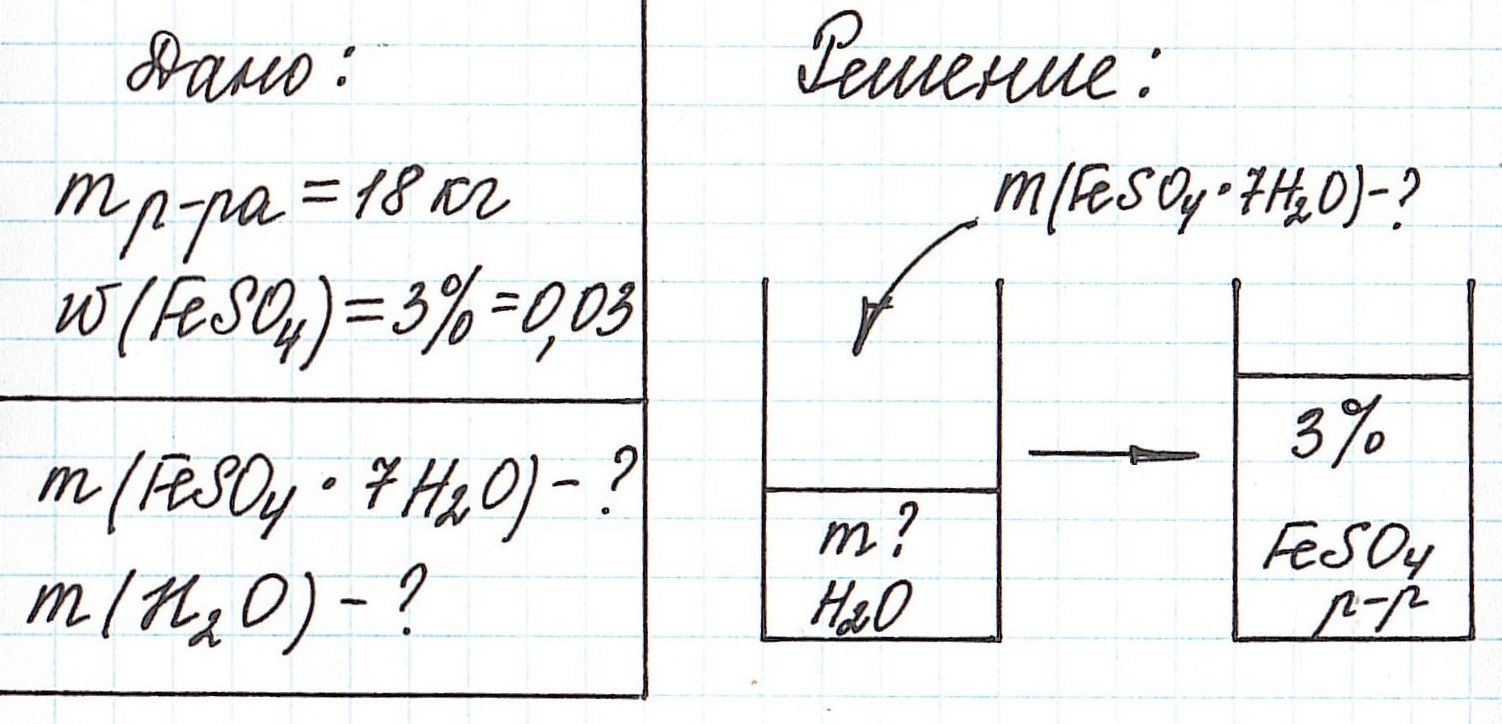
Пример 11. Какая масса железного купороса FeSO4·7H2O и воды потребуется для приготовления 18 кг раствора сульфата железа (II) с массовой долей FeSO4 3%?
Обратите внимание, что масса раствора дана не в граммах (г), а в килограммах (кг). Для того, чтобы привести в ходе расчетов все единицы измерения к единой системе, можно перевести килограммы в граммы и вычислять как обычно.
Но есть более простой способ. Можно считать количество вещества не в моль, а в киломоль (кмоль). Молярную массу вычислять не в г/моль, а в кг/кмоль. В этом случае ответ в задаче мы сразу получим в килограммах.
Пример 12. Вычислите массу кристаллогидрата сульфата никеля NiSO4·7H2O, который надо добавить к 180 г раствора с массовой долей сульфата никеля 1,5%, чтобы получить раствор с массовой долей соли 6%?
Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Правилом «креста» (или «квадратом Пирсона») очень удобно пользоваться в расчетах, связанных с разбавлением или смешиванием растворов.
Общая схема вычислений выглядит так:
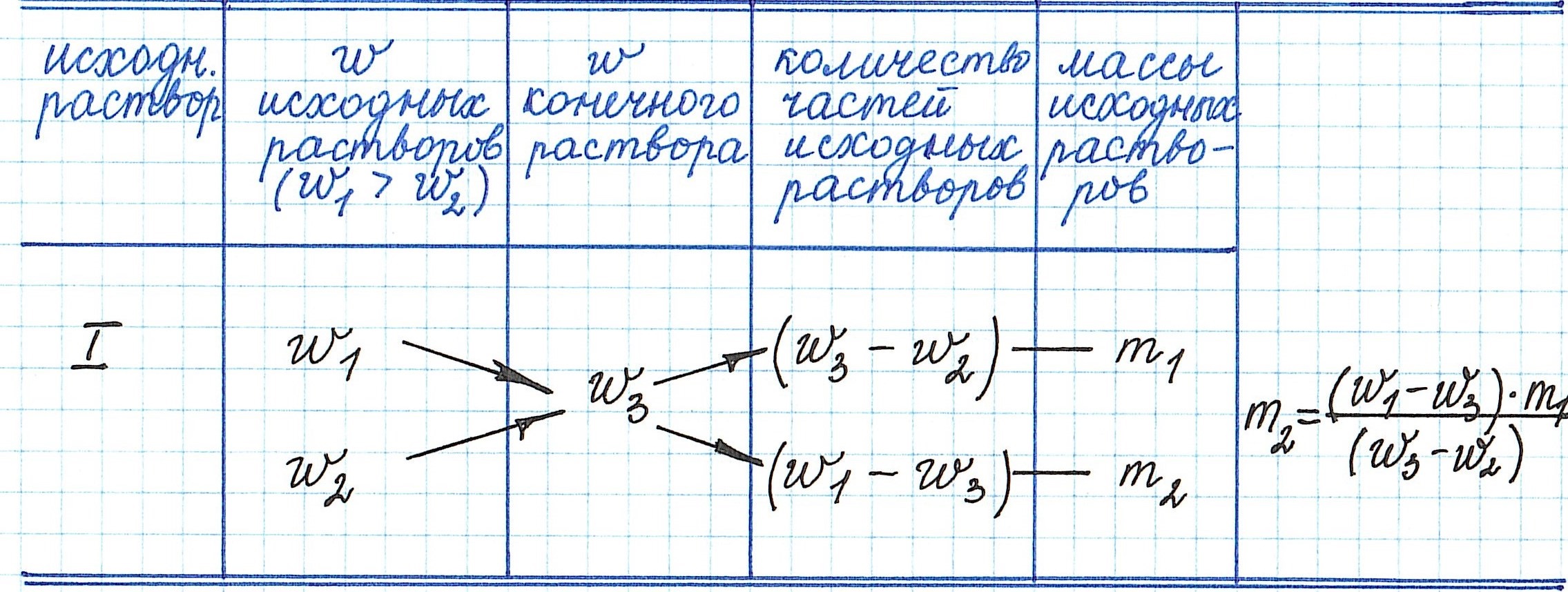
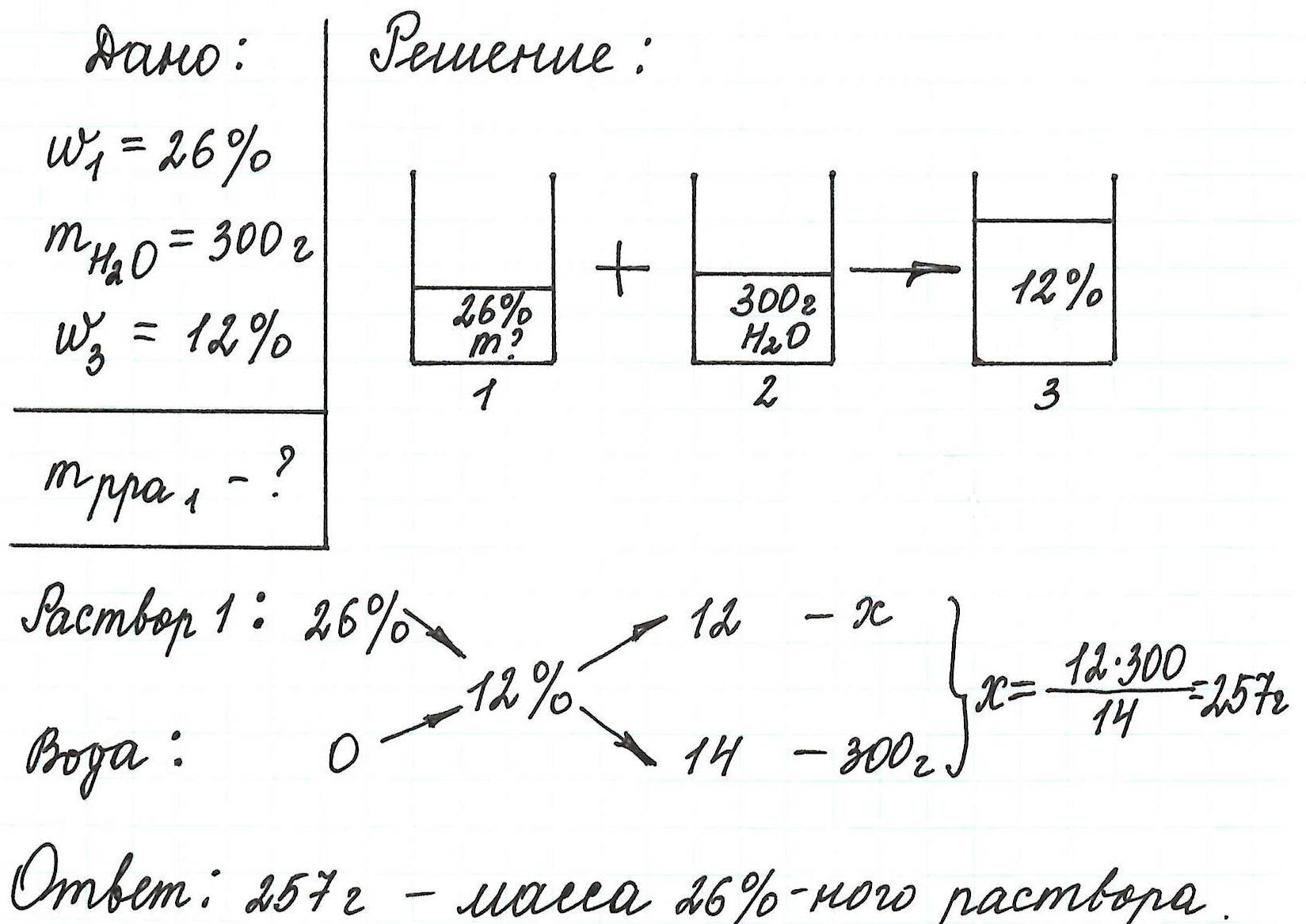
Пример 13. Какую массу 5%-ного раствора глюкозы надо добавить к 70 г 21%-ного раствора этого же вещества, чтобы получить 12%-ный раствор?
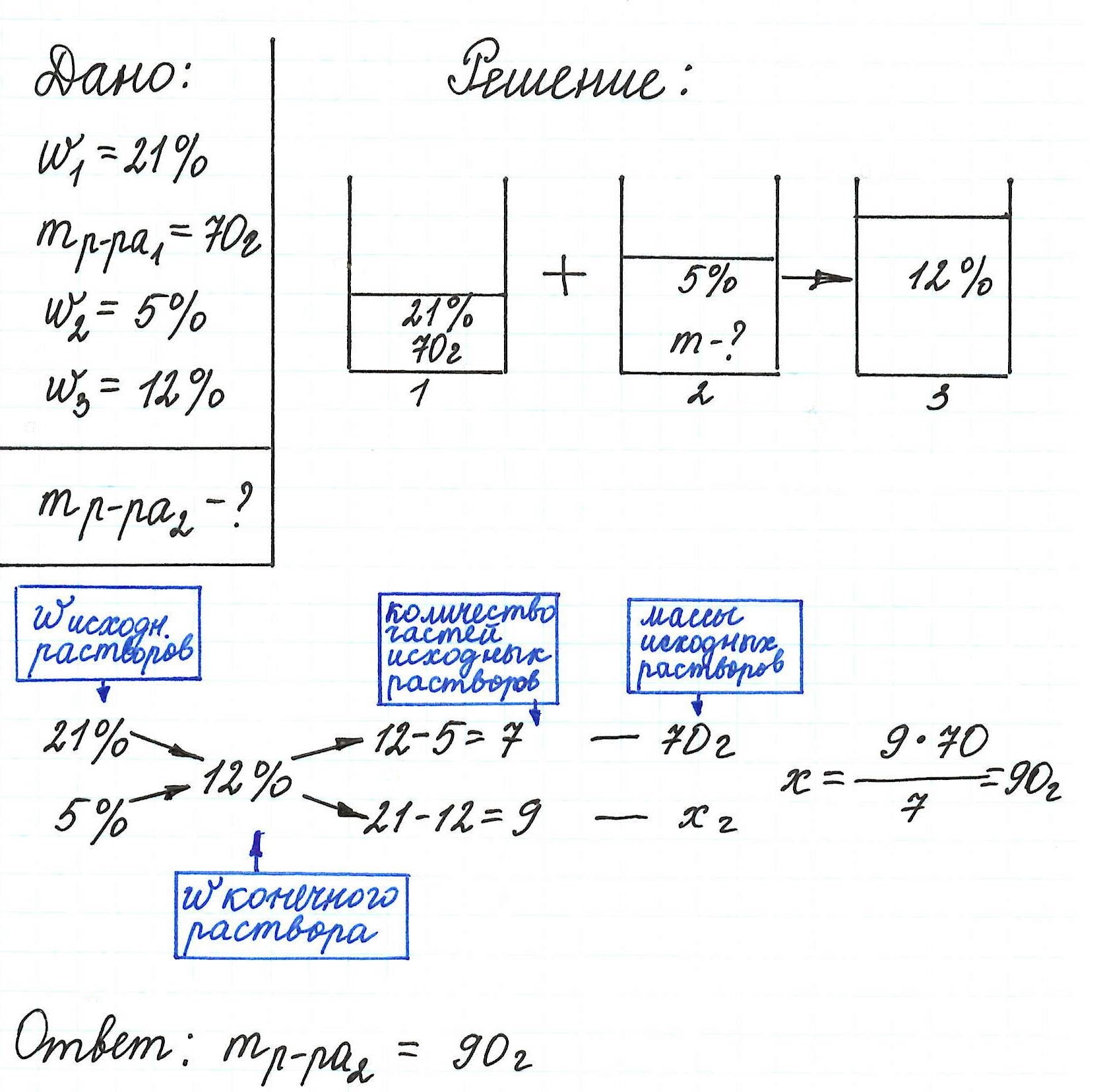
Еще примеры с применением правила «креста» можно посмотреть здесь.
Мы рассмотрели достаточно примеров расчетов, где используется формула такой концентрации раствора как массовая доля растворенного вещества. Как видим, ситуаций, в которых требуется ее применение, множество. Однако, есть достаточно случаев, когда более приемлемыми являются формулы других концентраций (молярной, нормальной, титра и т.д.). Об этом читайте в других статьях.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Концентрация растворов. Растворы неэлектролитов. Растворимость
Задача:
Расчеты по процентной концентрации растворов. Формула, выражающая процентную концентрацию раствора —
где 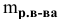
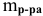
Задача:
Рассчитать процентную концентрацию раствора, полученного растворением 80 г сахара в 160 г воды.
Решение:
Задача:
Рассчитать массы поваренной соли и воды, необходимые для приготовления 250 г 2,5%-ного раствора.
Решение:
Задача:
Рассчитать концентрацию раствора, полученного смешением З00 г 10%-ного раствора хлороводорода и 400г 20%-ного раствора хлороводорода.
Решение:
Определяем массы растворенной 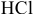
После смешивания
Определяем концентрацию полученного раствора:
Задача:
Какова концентрация серной кислоты в растворе, полученном смешиванием 200г 10%-ного раствора серной кислоты и 100г 5%-ного раствора сульфата натрия?
Решение:
Масса полученного раствора определяется как сумма масс смешанных растворов:
Далее определим концентрацию серной кислоты в полученном растворе:
Задача:
Расчеты по молярной концентрации (молярности) раствора.
Формула для расчета молярности раствора —
где С — молярность раствора, моль/л;
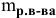
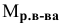
V — объем раствора, мл; если объем выражается в литрах, тогда в формуле исчезает коэффициент 1000.
Задача:
Какая масса серной кислоты необходима для приготовления 2 л 2-молярного раствора?
Решение:
Задача:
250 мл раствора содержат 7г КОН. Какова молярность этого раствора?
Решение:
Задача:
Расчеты по нормальной концентрации (нормальности) раствора.
Для расчета нормальности пользуемся следующей формулой:
где 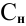
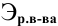
Задача:
Какая масса фосфорной кислоты необходима для приготовления 2 л 0,1 н раствора?
Решение:
Задача:
Расчеты по разбавлению растворов.
Выведем формулу для расчетов при разбавлении растворов, учитывая, что концентрация как исходного, так и приготовленного растворов может быть выражена любым способом 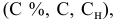
Для раствора, концентрация которого выражена в процентах,
а так как
то
где 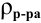
Для молярной концентрации
Для нормальной концентрации
Приравниваем правые части уравнений:
Задача:
Сколько миллилитров 98%-ного раствора серной кислоты
(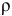
Решение:
Воспользуемся первым членом приведенного выше уравнения для концентрированного исходного раствора кислоты и третьим членом — для приготовления разбавленного раствора серной кислоты:
где С% = 98 %;
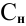
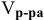
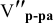
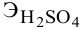
Отсюда
Задача:
Расчеты по переходу от одного способа выражения концентрации данного раствора к другому.
При переходе от одной концентрации данного раствора к другой остаются постоянными не только масса растворенного вещества, но и объем раствора, т.е.
Предыдущая формула принимает следующий вид:
Задача:
Определить молярность 36,5%-ного раствора соляной кислоты (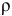
Решение:
Воспользуется первым и вторым членами последнего уравнения и выведем выражение для определения молярности:
Задача:
Расчеты по законам Рауля. Давление паров разбавленного раствора.
По закону Рауля, понижение давления пара 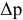
где 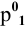
N — мольная доля растворенного вещества,
где 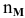
где 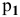
Отсюда
Задача:
Определить давление насыщенных паров раствора, содержащего 45 г глюкозы 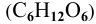
Решение:
Рассчитываем мольную долю растворенного вещества:
Определяем давление паров воды над раствором:
Задача:
Расчеты по понижению температуры замерзания растворов.
По закону Рауля понижение температуры замерзания прямо пропорционально моляльной концентрации раствора:
где 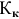
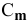
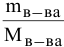
Отсюда
Задача:
Рассчитать температуру замерзания 3%-ного водного раствора этиленгликоля
Решение:
Выведем формулу для перехода от процентной концентрации к моляльности раствора.
Для процентной концентрации
Для моляльности
Отсюда
Если принять 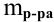
Находим моляльность рассматриваемого раствора:
Рассчитаем понижение температуры замерзания раствора:
Температура замерзания водного раствора
Задача:
Рассчитать температуру кипения 0,1 молярного водного раствора глюкозы (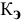
Решение:
Формула для перехода от молярной концентрации к моляльной —
Так как раствор разбавленный, то принимаем 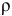
Определяем повышение температуры кипения раствора:
Температура кипения этого раствора
Задача:
Расчеты по уравнению химической реакции, протекающей в растворе.
Для химического уравнения общего вида
верно следующее соотношение числа эквивалентов:
Если участвующие в реакции вещества взяты в виде растворов и если их концентрации выражены:
а) для вещества А — С %;
б) для вещества В — С (молярность);
в) для вещества С — 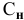
тогда массы и число эквивалентов каждого из веществ, находящихся в определенных объемах растворов этих веществ, определяются по формулам:
Так как числа эквивалентов, участвующих в реакции веществ, равны между собой, то можно записать:
Если концентрации участвующих в реакции веществ выражены в нормальности, то формула для расчетов приобретает вид:
Задача:
Какой объем 0,2 н раствора щелочи необходим для осаждения 2,708 г хлорида трехвалентного железа в виде гидроксида железа?
Решение:
Предложенный метод не требует обязательного написания уравнения реакции для осуществления таких расчетов.
Отсюда
Задача:
Для нейтрализации 20 мл 2-молярного раствора 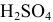
Решение:
Формула для расчета —
Так как 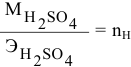
откуда
Задача:
Какой объем 80 %-ного раствора 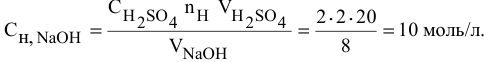
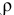
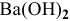
Решение:
Формула для расчета —
Так как 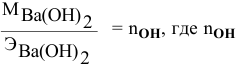
Отсюда
Задача:
Какой объем 0,2 н раствора щелочи необходим для реакции осаждения 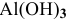
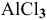
Решение:
Формула для расчета —
Задача:
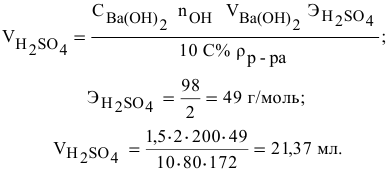
Смешивается 300 мл 0,5 М раствора хлорида бария со 100 мл 6 %-ного раствора серной кислоты (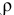
Решение:
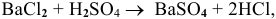
Так как указаны количества обоих реагирующих веществ, то необходимо определить вещество, взятое в избытке.
Таким образом, 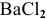
Дальнейший расчет производим по веществу, взятому в недостатке, т.е. по серной кислоте.
Так как
находим массу
откуда
Задача:
Для приготовления насыщенного раствора К.С1 при 40°С взято 50г воды и 20г КС1. Какова растворимость К.С1 в воде при данной температуре?
Решение:
Задача:
В 300г горячей воды растворено 219г 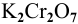
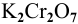
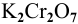
Решение:
Определяем, сколько может быть растворено 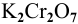
Откуда
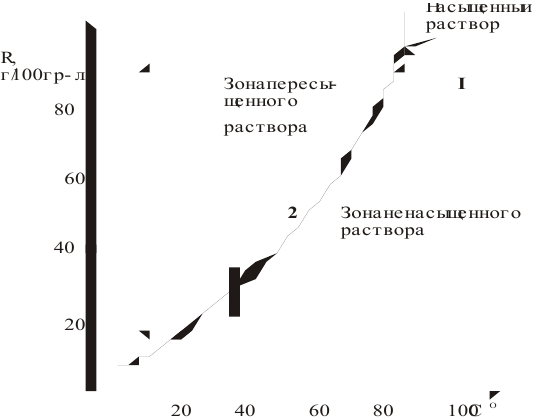
Масса кристаллов — это разность массы растворенного вещества в горячем растворе и массы растворенного вещества в охлажденном растворе (рис.З):
Рис. 3 — Графическое изображение процесса выпадения кристаллов при охлаждении раствора:
1 — участок охлаждения ненасыщенного раствора от заданной температуры до температуры образования насыщенного раствора;
2 — участок охлаждения насыщенного раствора до заданной температуры с уменьшением растворимости вещества, что приводит к его кристаллизации (в данном случае мы предполагаем, что пересыщенный раствор не образуется).
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны: