Рассчитать объем азота.
Рассчитать объем азота (газа) при нормальных условиях, если известна его масса, можно по формуле: V = m · Vm / M = ν · Vm. Рассчитать объем азота (газа), если известна его масса, температура и давление, можно по формуле: V = m · R · T / (p · M) = ν · R · T / p.
Химическая формула азота N₂.
Расчет объема азота (газа)
Теория расчета объема газа
Пример: Рассчитайте объем для 140 кг азота
Рассчитать объем газа: азота, водорода, воздуха, гелия, озона, кислорода, углекислого газа, хлора
Рассчитать объем азота (газа) при нормальных условиях:
Рассчитать объем азота (газа):
Теория:
Рассчитать объем азота (газа) при нормальных условиях, если известна его масса, можно по формуле:
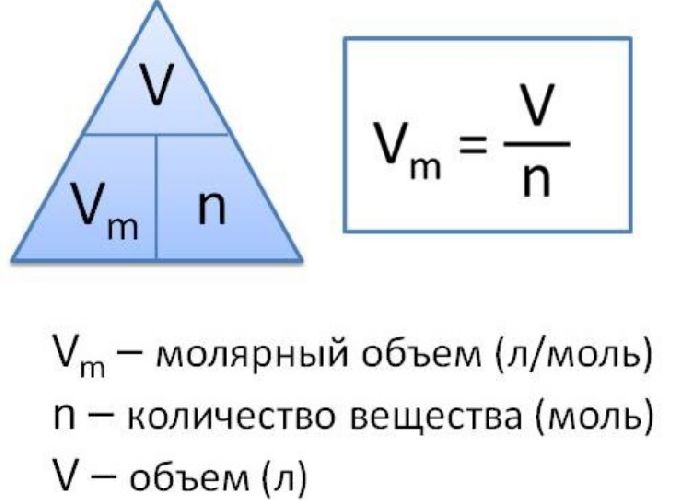
V = m · Vm / M = ν · Vm,
где
V – объем газа, л,
ν – количество вещества, моль,
Vm – молярный объем газа, л/моль, Vm = 22,4 л/моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(N₂) = 2·14 = 28 г/моль.
Нормальные условия: 0 оС (или 273,15 К), 101,325 кПа или 1 атм.
Рассчитать объем азота (газа), если известна его масса, температура и давление, можно по формуле:
V = m · R · T / (p · M) = ν · R · T / p,
где
V – объем газа, л,
ν – количество вещества, моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(N2) = 2·14 = 28 г/моль,
R – универсальная газовая постоянная, R ≈ 8,314 Дж/(моль⋅К),
T – термодинамическая температура, К.
P – давление, кПа.
Пример: Рассчитайте объем для 140 кг азота:
Рассчитайте объем для 140 кг азота (газа) при нормальных условиях.
V = m · Vm / M = 140 000 грамм · 22,4 л/моль / 28 г/моль = 112 000 литров или 112 м3.
Рассчитайте объем для 140 кг азота (газа) при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = m · R · T / p · M = 140 000 грамм · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа · 28 г/моль) = 420 064,85 литров или 420,06485 м3.
Рассчитать объем газа: азота, водорода, воздуха, гелия, озона, кислорода, углекислого газа, хлора
Коэффициент востребованности
2 206
Молярный объем

4.2
Средняя оценка: 4.2
Всего получено оценок: 261.
4.2
Средняя оценка: 4.2
Всего получено оценок: 261.
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества, молярный объем. Так, что же такое молярный объем, и в чем его отличие для веществ в разном агрегатном состоянии?
Молярный объем: общая информация
Чтобы вычислить молярный объем химического вещества необходимо молярную массу этого вещества разделить на его плотность. Таким образом, молярный объем вычисляется по формуле:
Vm=M/p,
где Vm – молярный объем вещества, М – молярная масса, p – плотность. В Международной системе СИ эта величина измеряется в кубический метр на моль (м 3 /моль).
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно вывести, используя уравнение состояния для идеального газа, которое называется уравнением Клайперона-Менделеева:
P*V=n*R*T,
где R – универсальная газовая постоянная, R=8.314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8.314*273.15/101.325=22.413 л/моль, где Т и Р – значение температуры (К) и давления при нормальных условиях.
Закон Авогадро
В 1811 году А. Авогадро выдвинул гипотезу, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковой число молекул. Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого.
Закон становится понятен, если вспомнить, что в газообразном виде расстояние между частицами несопоставимо больше, чем размеры самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствие из закона Авогадро и понятие молярного объема основаны на том, что моль любого вещества содержит одинаковое число частиц (для газов – молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.
Что мы узнали?
В школьной программе по химии 8 класса изучается тема «Молярный объем». В одном моле газа всегда содержится одинаковый объем, равный 22,41 кубический метр/моль. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
10/10
-
Артак Саркисян
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 261.
А какая ваша оценка?
Рассчитайте количество вещества, массу и объём (н. у.) порции азота
N
2
, содержащей
9
,
03
∗
10
23
атомов азота.
reshalka.com
ГДЗ Химия 8 класс класс Габриелян. §19. Примените свои знания. Номер №8
Решение
Дано:
N (N) =
9
,
03
∗
10
23
Найти:
n − ?
m − ?
V − ?
Решение:
Зная количество атомов, найдем количество вещества: n = N : Na.
n (
N
2
) =
9
,
03
∗
10
23
:
6
,
02
∗
10
23
= 1,5 моль
Зная количества азота, можем найти массу: m = n * M.
m (
N
2
) = 1,5 моль * 28 г/моль = 42 г
Зная количество вещества, найдем объем газа: V = n * Vm.
V (
N
2
) = 1,5 моль * 22,4 л/моль = 33,6 л
Ответ: n = 1,5 моль; m = 42 г; V = 33,6 л.
Таблица молярных объёмов химических элементов.
Молярный объём – отношение объёма вещества к его количеству при определенной температуре и давлении.
Молярный объём имеет обозначение Vm.
Молярный объём численно равен объёму одного моля вещества.
Молярный объём в Международной системе единиц (СИ) измеряется в кубических метрах на моль, русское обозначение: м3/моль; международное: m3/mol.
Термин «молярный объём» может быть применён к простым веществам, химическим соединениям и смесям.
Молярный объём зависит от температуры, давления и агрегатного состояния вещества.
Молярный объём вещества вычисляется по формуле:
Vm = V/n = M/ρ,
где
V – объем вещества,
n – количество вещества,
M – молярная масса,
ρ – плотность вещества.
Таблица молярных объёмов химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Молярный объём, см3/моль |
| 1 | Водород | H | 11,21 |
| 2 | Гелий | He | 22,42354 |
| 3 | Литий | Li | 12,97383 |
| 4 | Бериллий | Be | 4,8767 |
| 5 | Бор | B | 4,3947 |
| 6 | Углерод | C | 5,314469 – графит,
3,42 – алмаз |
| 7 | Азот | N | 11,196 |
| 8 | Кислород | O | 11,196 |
| 9 | Фтор | F | 11,202 |
| 10 | Неон | Ne | 22,42 |
| 11 | Натрий | Na | 23,74976 |
| 12 | Магний | Mg | 13,984 |
| 13 | Алюминий | Al | 9,993 |
| 14 | Кремний | Si | 12,05386 |
| 15 | Фосфор | P | 16,99054 |
| 16 | Сера | S | 16,35969 |
| 17 | Хлор | Cl | 11,0308 |
| 18 | Аргон | Ar | 22,392 |
| 19 | Калий | K | 45,675584 |
| 20 | Кальций | Ca | 25,85677 |
| 21 | Скандий | Sc | 15,060606 |
| 22 | Титан | Ti | 10,62059 |
| 23 | Ванадий | V | 8,3373977 |
| 24 | Хром | Cr | 7,282 |
| 25 | Марганец | Mn | 7,35449 |
| 26 | Железо | Fe | 7,0923 |
| 27 | Кобальт | Co | 6,6217 |
| 28 | Никель | Ni | 6,58884 |
| 29 | Медь | Cu | 7,12399 |
| 30 | Цинк | Zn | 9,16092 |
Таблица молярных объёмов химических элементов (2 часть):
| 31 | Галлий | Ga | 11,80945 |
| 32 | Германий | Ge | 13,6464 |
| 33 | Мышьяк | As | 13,082 |
| 34 | Селен | Se | 16,3851 |
| 35 | Бром | Br | 25,610256 |
| 36 | Криптон | Kr | 22,34613 |
| 37 | Рубидий | Rb | 55,78838 |
| 38 | Стронций | Sr | 33,315589 |
| 39 | Иттрий | Y | 19,88 |
| 40 | Цирконий | Zr | 14,01075 |
| 41 | Ниобий | Nb | 10,84 |
| 42 | Молибден | Mo | 9,33 |
| 43 | Технеций | Tc | 8,5217 |
| 44 | Рутений | Ru | 8,17057 |
| 45 | Родий | Rh | 8,2655 |
| 46 | Палладий | Pd | 8,851 |
| 47 | Серебро | Ag | 10,282955 |
| 48 | Кадмий | Cd | 12,995 |
| 49 | Индий | In | 15,7 |
| 50 | Олово | Sn | 16,239398 |
| 51 | Сурьма | Sb | 18,181275 |
| 52 | Теллур | Te | 20,4487 |
| 53 | Йод | I | 25,689 |
| 54 | Ксенон | Xe | 22,253 |
| 55 | Цезий | Cs | 70,732 |
| 56 | Барий | Ba | 39,1245 |
| 57 | Лантан | La | 22,6 |
| 58 | Церий | Ce | 20,9472 |
| 59 | Празеодим | Pr | 21,221 |
| 60 | Неодим | Nd | 20,5763 |
Таблица молярных объёмов химических элементов (3 часть):
| 61 | Прометий | Pm | 19,961 |
| 62 | Самарий | Sm | 20,4487964 |
| 63 | Европий | Eu | 28,978642 |
| 64 | Гадолиний | Gd | 19,9 |
| 65 | Тербий | Tb | 19,3363 |
| 66 | Диспрозий | Dy | 19,0 |
| 67 | Гольмий | Ho | 18,7527 |
| 68 | Эрбий | Er | 18,449 |
| 69 | Тулий | Tm | 18,124 |
| 70 | Иттербий | Yb | 26,33789 |
| 71 | Лютеций | Lu | 17,77939 |
| 72 | Гафний | Hf | 13,41 |
| 73 | Тантал | Ta | 10,86774 |
| 74 | Вольфрам | W | 9,55 |
| 75 | Рений | Re | 8,858563 |
| 76 | Осмий | Os | 8,42 |
| 77 | Иридий | Ir | 8,52 |
| 78 | Платина | Pt | 9,249786 |
| 79 | Золото | Au | 10,2 |
| 80 | Ртуть | Hg | 14,821 |
| 81 | Таллий | Tl | 17,247535 |
| 82 | Свинец | Pb | 18,2716 |
| 83 | Висмут | Bi | 21,3681 |
| 84 | Полоний | Po | 22,727272 |
| 85 | Астат | At | 32,94 − предположительно |
| 86 | Радон | Rn | 22,816 |
| 87 | Франций | Fr | нет данных |
| 88 | Радий | Ra | 45,2 |
| 89 | Актиний | Ac | 22,5422 |
| 90 | Торий | Th | 19,791717 |
Таблица молярных объёмов химических элементов (4 часть):
| 91 | Протактиний | Pa | 15,03 |
| 92 | Уран | U | 12,4949559 |
| 93 | Нептуний | Np | 11,5892 |
| 94 | Плутоний | Pu | 12,313 |
| 95 | Америций | Am | 17,77615 |
| 96 | Кюрий | Cm | 18,28275 |
| 97 | Берклий | Bk | 16,71 |
| 98 | Калифорний | Cf | 16,62 |
| 99 | Эйнштейний | Es | нет данных |
| 100 | Фермий | Fm | нет данных |
| 101 | Менделевий | Md | нет данных |
| 102 | Нобелий | No | нет данных |
| 103 | Лоуренсий | Lr | нет данных |
| 104 | Резерфордий (Курчатовий) | Rf | нет данных |
| 105 | Дубний (Нильсборий) | Db | нет данных |
| 106 | Сиборгий | Sg | нет данных |
| 107 | Борий | Bh | нет данных |
| 108 | Хассий | Hs | нет данных |
| 109 | Мейтнерий | Mt | нет данных |
| 110 | Дармштадтий | Ds | нет данных |
Источник: https://www.schoolmykids.com
Коэффициент востребованности
3 872
Объем газа в молях это отношение объёма вещества к его количеству, численно равен объёму одного моля вещества.
Значение «молярный объём» иногда применяют к простым веществам, а также химическим соединениям и смесям. В общем случае он зависит от температуры, давления и агрегатного состояния вещества.
Формула расчета объема газа в газах Vm = RT/P где где R — универсальная газовая постоянная, T — термодинамическая температура, P — давление.
Объем, занимаемый молем азота N2
Одной из самых важных закономерностей, наблюдаемых в поведении газов, является постоянство объема, занимаемого молем газа.
Изучение этого вопроса с сопоставления размеров газообразных частиц со средним расстоянием между ними при нормальных условиях температуры и давления.
Молекулярная формула азота — N2; молекула азота двухатомна. Следовательно, 1 моль N2 содержит 2 моля атомов азота. 1 моль N2 весит 28,0 г.
При достаточно низкой температуре (ниже —210° С) азот представляет собой твердое вещество с плотностью 1,03 г/см3. Объем, занимаемый 1 молем твердого вещества, называется молярным объемом:
VN2, тв = (28,0 г/моль)/(1,03г/см3) = 27,2 см3/моль
Если нагреть твердое вещество до —210 ° С, то оно расплавится и образуется жидкий азот. Плотность этой жидкости равна 0,81 г/см3. Таким образом, объем 1 моля жидкого азота определяется следующим образом:
VN2, ж = (28,0 г/моль)/(0,81г/см3)= 34,6 см3/моль
Если повышать температуру и дальше, то жидкость испаряется и образуется газ, заполняющий сосуд.
От чего зависит плотность газа
Плотность газа зависит от объема сосуда и температуры. Для удобства сравнения предположим, что 1 моль газообразного азота заполняет сосуд такого объема, что в нем создается давление 1 атм, если сосуд помещен в баню со льдом при 0° С.
В этом случае плотность газа составляет лишь 0,00125 г/см3. Это означает, что молярный объем газообразного азота при 0° С и 1 атм будет равен
VN2. г = (28,0 г/моль)/(0,00125 г/см3) = 22,4 • 103см3/моль = 22.4 л/моль
Объем этого газа почти в 1000 раз больше объема того же количества твердого вещества. Опыты с другими газами приводят к тем же результатам.
Если принять, что размер отдельных молекул твердого вещества и газа одинаков, то в газообразном состоянии молекулы должны быть удалены друг от друга.
Свободное пространство между молекулами газа примерно в 1000 раз превышает объем, занимаемый молекулами твердого вещества.
Сопоставление молярных объемов газов
Объем 22,4 л, вычисленный выше, нам уже встречался. В табл. 1 указано, что произведение давления и объема 32,0 г кислорода при 0° С равно 22,4. (Заметим, что 32,0 г — вес 1 моля O2). Мы можем использовать выражение
PV = 22,4((л•атм)/(моль)) (при 0°С)
для определения объема 1 моля О2 при давлении 1 атм:
1 атм • V = 22,4((л•атм)/(моль))
V = 22,4((л•атм)/(моль))
V = 22,4 л/моль
Получм тот же объем, что и для 1 моля азота при 0° С и давлении 1 атм. Такой же объем занимают 17,0 г аммиака при 0°С и давлении 1 атм.
Аммиак имеет молекулярную формулу NH3; следовательно, его молекулярный вес равен (14,0 + 3•1,0) = 17,0 г. Таким образом, 1 моль аммиака (17,0 г) тоже занимает объем 22,4 л при 0° С и давлении 1 атм.
Опыты с многими другими газами приводят к аналогичному выводу:
1 моль газа занимает объем 22,4 л при 0°С и давлении 1 атм (1)
Что произойдет с газом, если температура изменится? Ответ дают экспериментальные данные. В табл.1 приведены результаты измерений для газообразного аммиака при 25° С (т. е. при комнатной температуре).
Хотя эти данные содержат некоторую экспериментальную ошибку, вновь обнаруживается закономерность PV = const.
Давление и объем 17,0 г газообразного аммиака NH3 при 25°С
Таблица1
| Давление Р, атм | Объем V, л | PV |
| 0,200 | 123 | 24,6 |
| 0,400 | 60.0 | 24,0 |
| 0,600 | 43,0 | 25,8 |
| 0,800 | 29,3 | 23,4 |
| 1,00 | 25,7 | 25,7 |
| 1,50 | 15,9 | 23,9 |
| 2,00 | 12,1 | 24,2 |
| Среднее 24,5 ± 0,7 |
Однако на этот раз произведение объема и давления для 1 моля аммиака равно 24,5±0,7. Мы можем сравнить эту величину с результатом, полученным ранее:
Для 1 моля аммиака при 0°С PV = 22,4 л • атм (2)
Для 1 моля аммиака при 25° С PV = 24,5 л•атм (3)
Зависимость молярного объема от температуры
Уравнение (3) показывает, что молярный объем аммиака при 25° С и давлении 1 атм равен 24,5 л, а при 0° С — 22,4 л. Следовательно, молярный объем аммиака зависит от температуры.
Это не является неожиданным: любой газ, если его нагревать при постоянном давлении, расширяется.
Поэтому когда мы сравниваем молярные объемы различных газов, они должны быть измерены при одинаковой температуре (и по той же причине при одинаковом давлении).
Опыты с газами
Рассмотрим следующий опыт. Колбу емкостью 1 л, из которой откачан воздух, взвешивают. Затем колбу заполняют газом при 25° С и давлении 1 атм и снова взвешивают. Разность двух весов дает вес 1 л газа.
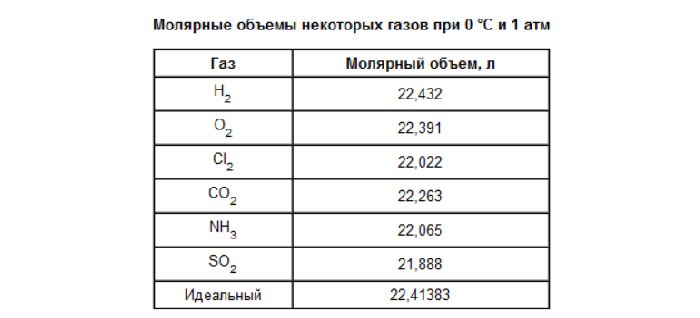
По этим данным мы можем вычислить объем 1 моля этого газа. В табл. 2 приведены результаты расчета. Мы видим, что все газы имеют приблизительно одинаковый молярный объем при 25° С и 1 атм.
Любой газ — О2, N2, СО или СО2, занимающий объем 24,5 ± 0,2 л, содержит 6,02•10м молекул (при 25° С и 1 атм). Объем 22,4±0,1 л N2, СО или какого-либо другого газа содержит 6,02 • 10м молекул при 0° С и 1 атм.
Закон Авогадро
Если сравнивать различные газы при одинаковых температуре и давлении, то легко показать, что они имеют одинаковый молярный объем.
Это наблюдается не только при 0° С и 1 атм, но, что еще более важно, и при других температурах и давлениях.
Таблица 2
Объем 1 моля газа при температуре 0°С и давлении 1 атм
|
Газ |
Вес пустой колбы W1, г | Вес колбы с газом W2, г | Вес 1 л газа W2,—W1,. г |
Молекулярный вес MW. г |
Объем MW/(W2 — W2)A |
| Кислород О2 | 157,35 | 158,66 | 1,31 | 32,0 | 24,5 |
| Азот N2 | 157,35 | 158,50 | 1,15 | 28,0 | 24,3 |
| Окись углерода СО | 157,35 | 158,50 | 1,15 | 28,0 | 24,4 |
| Двуокись углерода CO2 | 157,35 | 159,16 | 1.81 | 44,0 | 24,3 |
Когда реагируют два газа, например аммиак NH3 и хлористый водород НСl, то 1 л аммиака реагирует с 1 л хлористого водорода, если объемы обоих газов измерены при одинаковых температуре и давлении Это простое отношение объемов (1 : 1) наблюдается не только при 0°С и 1 атм, но, что еще более важно, и при других температурах и давлениях.
Эти и другие подобные результаты привели к тому, что Авогадро выдвинул свою знаменитую гипотезу. По этой гипотезе, равные объемы газов содержат одинаковое число молекул (при одинаковых температуре и давлении).
Следовательно, молекулярный вес газа можно определить сравнением веса известного объема газа с весом такого же объема другого газа с известным молекулярным весом. Какими будут величины Р и t, не имеет значения, поскольку они одинаковы для обоих газов.
Гипотеза Авогадро
Гипотезу Авогадро часто называют законом Авогадро, так как она нашла очень широкое применение. Это одна из наиболее важных закономерностей в химии.
Она важна не потому, что дает точные результаты, а вследствие применимости ко всем газам независимо от размера их молекул. Молекулы различных газов имеют различные размеры и несколько отличаются по силе притяжения друг к другу.
В связи с этим в данном объеме различных газов содержится неодинаковое число молекул. Такие отклонения невелики (обычно меньше 1 %) и не снижают значения гипотезы Авогадро как метода определения молекулярного веса газа.
Интересно отметить, что эта важнейшая закономерность, теперь часто называемая законом, в течение полувека с момента выдвижения не была признана.
Авогадро предложил свою гипотезу в 1811 г., но только в 1858 г. на Международном конгрессе химиков в Карлсруэ (Германия) она получила всеобщее признание.
В настоящее время мы можем привести множество примеров, доказывающих справедливость этой гипотезы, так как в нашем распоряжении имеются многочисленные количественные данные об отношениях весов и объемов газов.
Наоборот, в начале XIX в. не были известны точные атомные веса и не были окончательно разработаны.
Практическое занятие по теме объем газа в молях
Сколько молекул азота содержится в 1 л газа при 0° С и давлении 1 атм?
а) Вычислите объем (в миллилитрах), занимаемый одной молекулой азота в твердой фазе.
б) Зная, что 1 мл = 1,00 см3, определите размер (в сантиметрах) кубика объемом, рассчитанным в пункте (а). Используйте одну значащую цифру, Выразите ответ в ангстремах (1 Å = 10-8 см).