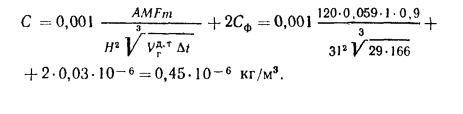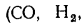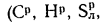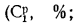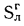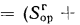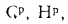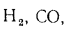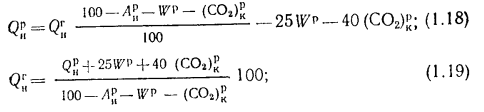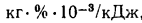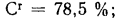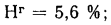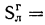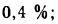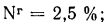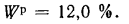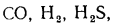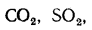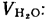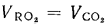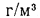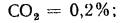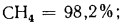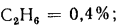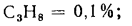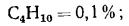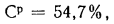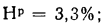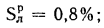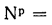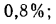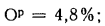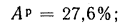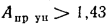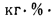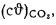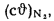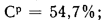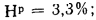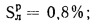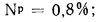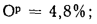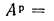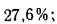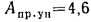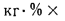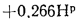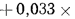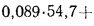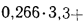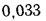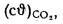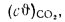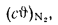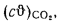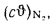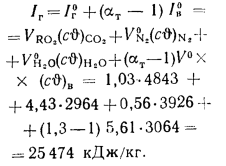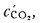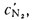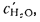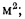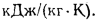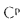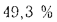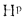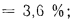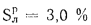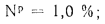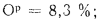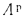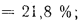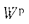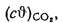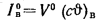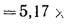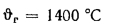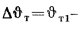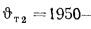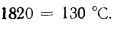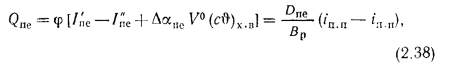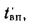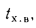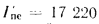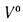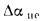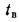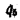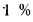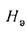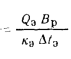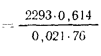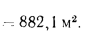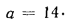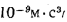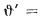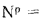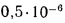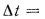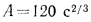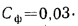Масса топлива рассчитывается по формуле M = V*p (масса равна произведению объема и плотности). Плотность дизельного топлива не является постоянной — она меняется в зависимости от марки топлива (сезонности) и температуры. ГОСТом 305-2013 установлены максимальные величины плотности для дизтоплива разных марок.
Как посчитать массу топлива?
Для перевода количества топлива из литров в тонны, необходимо воспользоваться обратной формулой: M = V x 0,840 /1000, (т), где V – объем топлива в литрах; M – масса топлива в тоннах; 0,840 – плотность топлива, кг/л.
Как перевести солярку из литров в кг?
Ответ: 1 кг солярки равен 1.19 литра. Вопрос: Сколько литров в килограмме солярки? Ответ: 1 литр солярки равен 0.84 килограмм (кг).
Как найти массу из литров?
1 л = 0,001 м3, следовательно, 3 л составляют 0,003 м3. Решение: Чтобы найти массу тела, нужно плотность умножить на объем: m = ρ · V.
Как перевести литры в кг формула?
Перевод килограмм в литры можно осуществить по формуле: V = M / p.
Как правильно перевести литры в тонны?
Как пересчитать литры в тонны? Для подсчета массы топлива необходимо преобразовать формулу, использованную прежде. Получим: m=V* ρ, в нашем случае: m=V*0,769/1000 (результат в тоннах).
Как рассчитать плотность бензина?
4. Как измерить плотность
- взять любую емкость с градуированными делениями;
- взвесить емкость;
- влить в емкость 100 мл топлива;
- выполнить взвешивание жидкости и найти разницу значений измерений;
- результат разделить на объем топлива.
9.08.2020
Сколько литров дизельного топлива в 1 кг?
Формула перевода из килограммов в литры будет такая: m · 1000/p. Используя ее, легко перевести 1 кг дизтоплива в литры: 1 · 1000/863,4 = 1,16 л (для летней марки).
Как перевести дизельное топливо из литров в тонны?
Для того, чтобы перевести количество топлива в тонны из литров, используют обратную формулу: M = V x 0,769 /1000, (т), V – объем топлива, (л); M – масса, (т); 0,769 – плотность, (кг/л.)
Как перевести кг в литры ДТ?
Плотность дизтоплива была вычислена в соответствии с расчетом килограмм на литр, поэтому выявление количества топлива в литрах будет произведено по формуле: V = (M / 0,769) х 1000, л.
Как найти массу 1 л воды?
Как определить массу жидкости, если известен ее объем
Точная масса жидкости высчитывается по формуле: m = p * v, где: M — это масса (в кг); p — плотность (в кг/м 3); v — объем (в м 3). Напомним, что 1 л = 0, 0001 м 3 .
Как найти массу масла?
В принципе все просто — берем плотность масла и умножаем на объем — получаем массу.
Как найти массу?
Масса тела выражается через плотность и объем следующей формулой: Масса тела — есть произведение плотности вещества из которого состоит тело на его объем. … m — масса тела, (килограмм), ρ — плотность вещества, (кг/м³).
Сколько литров в 1 кг?
Чтобы узнать сколько литров имеется в 1 килограмме, надо умножить количество килограммов на величину плотности. Это можно объяснить посредством простого примера: сколько будет весить 1 литр краски водоэмульсионной, имеющий плотность 1,5 кг/л: 1л*1,5 кг/л =1,5 кг.
Как перевести 1 литр воды в кг?
Ответ: 1 кг воды равен 1 литру. Вопрос: Сколько литров в килограмме воды? Ответ: 1 литр воды равен 1 килограмму (кг).
Как перевести литры в кг м3?
1 кг/литр = 1000 кг/м3 (1 килограмм на литр = 1000 килограмм на кубический метр)
- Telegram.
- Viber. WhatsApp.
И так решим по основному алгоритму!
Начнем с дано
Дано:
S1=30 км/ч = в систему С вычисляем 30 км умножаем на 1000 = 30000м
v1=15м/c
S2= 40 км/ч = 40000
I2= 1ч = 3600c
Найти:
Vср — ? Vср1-? Vср2-?
Решение:
Vср1= S1/t1=> Vср2= S2/t2 => Vср= S1+S2/t1+t2;
Vср2= 12км/0.3ч = 40 км/ч приблизительно
Vср1= 4км/0.2ч = 20 км/ч
И так от сюда следует что Средняя скорость равна:
Vср= 4 км + 12 км/ 0.2 ч + 0.3 ч = 16 км/0.5 ч = 32 км/ч
Ответ: Vср1 — 20 км/ч; Vcp2 — 40 км/ч; Vcp — 32км/ч
gt1^2/2=h1
t1=sqrt(2h1/g)=sqrt(20)
t2=sqrt(18)
t=4,4-4.24=0.16 pervye desyat metrov
100 metrov =10raz po 10 metrov
16-0,16=15,84 sec
Силы Архимеда будут одинаковыми так как Fa=pgV
дельтаU (внутренняя энергия) = m/M*дельтаT(изменение температуры) = 10/18*10^-3*(358-273) = 47.2*10^3 Дж
Решается эта задача с помощью уравнения теплового баланса.
Литры или тонны — в чем считать дизельное топливо
Литры или тонны — в чем считать дизельное топливо
Проблема пересчета дизельного топлива заключается в том, что для разных целей используют разные единицы измерения. Например, при заправке транспортного средства топливо считают в литрах, поскольку бензобак рассчитан на определенный объем горючего. При перевозке партии дизельного топлива рассчитывается его масса в тоннах, потому что транспортные средства имеют ограничения по грузоподъемности. Перерасчет производится также и в бухгалтерских целях.
Что же касается взаиморасчетов между поставщиком нефтепродуктов и оптовым покупателем, то в этом случае целесообразнее использовать в качестве единиц измерения всё же тонны. Причина этому — физические свойства дизельного топлива, а именно особенность жидкости изменять объем в зависимости от изменений температуры.
Масса топлива рассчитывается по формуле M = V*p (масса равна произведению объема и плотности).
Плотность дизельного топлива не является постоянной — она меняется в зависимости от марки топлива (сезонности) и температуры. ГОСТом 305-2013 установлены максимальные величины плотности для дизтоплива разных марок. Так, плотность летнего топлива не может быть больше значения 863,4 кг/м3, а зимнего — не более 843,4 кг/м3. Но это максимальные, а не обязательные величины, причем установленные для температуры окружающей среды 15oС.
При изменении температуры топлива на 1oС его плотность изменится обратно пропорционально в среднем на 0,7 кг/м3. Чем выше температура, тем меньше плотность. То есть, если при температуре воздуха 15oС плотность дизельного топлива составляет, например, 860 кг/м3, то при 20oС плотность будет составлять 856,5 кг/м3.
Теперь вернемся к формуле расчета массы M = V*p. Если бы мы рассчитывали массу по постоянному объему, например, в 10000 литров (10 кубометров), то получили бы вес нашей партии топлива при температуре окружающей среды 15oС равный 8600 кг, а при температуре 20oС — 8565 кг. Однако, для этого нам пришлось бы поместить указанный объем топлива в условия, препятствующие изменению объема в связи с изменением температуры. В вакуум, например. Но поскольку на сегодняшний день никто не перевозит оптовые партии топлива в вакуумных емкостях, жидкость в зависимости от изменения температур имеет возможность свободно изменять объем — расширяться или сжиматься, как ей и положено по законам физики.
А вот масса как раз остается величиной постоянной, независимо от температуры окружающей среды и марки топлива. Если в бензовозы на нефтебазе залито 8600 кг дизельного топлива при 15oС, что составляет 10 м3, то к покупателю даже при повышении температуры до 20oС приедет 8,6 тонн, но объем партии уже будет составлять 10,04 куба, то есть на 40 литров больше.
Согласитесь — расчет с поставщиком по установленному на бензовозе счетчику в указанном случае будет не в пользу покупателя, но, увы, далеко не каждый оптовик располагает оборудованием, позволяющим взвесить закупленную партию при приемке. По этой причине большинство закупщиков дизельного топлива соглашаются на взаиморасчет по объему, производя перерасчет данных, полученных при приемке, и сверяя их со сведениями о партии, указанными в паспорте качества.
Важно помнить, что надежный поставщик нефтепродуктов на каждую партию дизельного топлива предоставляет паспорт качества, в котором указываются и масса отгруженного топлива в тоннах, и его установленная ГОСТом и фактическая плотность при 15oС. Если нет возможности взвесить партию при приемке, то при наличии паспорта качества легко рассчитать объем загруженного топлива. Всё, что потребуется от приемщика — измерить ареометром плотность топлива на момент приемки, умножить ее на принятый объем и сравнить полученный тоннаж с тем, что указан в паспорте качества. Главное — выбрать заботящегося о своей репутации поставщика с честной ценовой политикой.
Возникли вопросы?
Заполните форму обратной связи, наши менеджеры свяжутся с вами!
1.1. Элементарный состав твердого, газообразного и жидкого топлива
В базовой и промышленной энергетике для получения электрической и тепловой энергии используется в основном топливо органического происхождения.
Все виды органического топлива (горючие) представляют собой углеводородные соединения, в которые входят небольшие количества других веществ.
К твердому топливу относят: антрацит, каменный и бурый уголь, торф, дрова, сланцы, отходы лесопильных заводов и деревообделочных цехов, а также растительные отходы сельскохозяйственного производства — солому, костру, лузгу и др.
К жидкому топливу относят нефть, а также различные продукты ее переработки: бензин, керосин, лигроин, разнообразные масла и остаточный продукт нефтепереработки нефти — мазут.
До 70 % и более видов жидкого топлива используется на транспорте — авиационном, автомобильном, специальном водном, железнодорожном (тепловозы), около 30 % сжигается в виде мазута на тепловых электростанциях и в промышленных котельных.
К газообразному топливу относят природный газ, добываемый из недр земли, попутный нефтяной газ, газообразные отходы металлургического производства (коксовый и доменный газ), крекинговый газ, а также генераторный газ, получаемый искусственным путем из твердого топлива в особых газогенераторных установках.
Топливо в том виде, в каком оно поступает для сжигания в топки котлов или в двигатели внутреннего сгорания, называется рабочим.
В общем случае в состав рабочего (твердого или жидкого) топлива входят углерод С, водород Н, кислород О, азот N и летучая сера S, а также негорючие минеральные примеси — зола А и влага W.
Для рабочей массы топлива имеет место равенство:
Cp+ Hp+ Op+ Np+ Sp+ Ap+ Wp= 100 %, (1.1)
где СР, НР, ОР и т. д. — элементы рабочего топлива, % общей массы топлива.
Влага, содержащаяся в топливе совместно с золой, называется балластом топлива.
В естественных видах ископаемого твердого топлива встречается сера трех разновидностей:
1) органическая Sо, связанная с другими элементами топлива С, Н, N и О в виде сложных органических соединений;
2) колчеданная Sк в виде пирита, колчедана FeS2;
3) сульфатная Sсульф в виде солей серной кислоты (гипс, FeSО4и др.). Сульфаты представляют собой высокие окислы серы, поэтому находящаяся в них сера гореть не может. Присутствующие в топливе органическая и колчеданная серы сгорают, образуя токсичный сернистый ангидрид SO2и (в небольших количествах) еще более токсичный серный ангидрид SO3. Выброс их с продуктами сгорания вызывает загрязнение воздушного бассейна.
Органическая и колчеданная сера образуют вместе летучую горючую серу Sл. Общее содержание серы в топливе
Sобщ = Sо + Sк + Sсульф = Sл + Sсульф. (1.2)
В горючую часть топлива входит только летучая сера, остальная сера в горении участия не принимает и может быть отнесена к балласту топлива.
Для правильного представления тепловых свойств топлива вводится понятие горючей массы, для которой
Сг+ Нг+ Ог+ Nг+ Sгл= 100 %, (1.3)
где индекс вверху показывает, что процентный состав отдельных элементов отнесен к горючей массе.
Название «горючая масса» носит условный характер, так как действительно горючими ее элементами являются только углерод, водород и сера. Углерод — преобладающий компонент твердых и жидких топлив, в топливах его обычно содержится от 50 до 95 %, тогда как содержание водорода Нг колеблется в пределах от 1 до 11 %, а серы Sг — от 0 до 8 %. Горючую массу можно характеризовать как топливо, не содержащее золы и в абсолютно сухом состоянии. Содержание азота в горючей массе твердых топлив обычно составляет 1—2 % по массе. Несмотря на столь малое количество, азот является весьма вредным компонентом, поскольку при сгорании азотсодержащих соединений в высокотемпературных топках образуются сильнотоксичные оксиды NО и NO2(они образуются также и из атмосферного азота, но в
меньшей степени).
Для топлива, содержащего большое количество влаги (бурый уголь, торф, дрова, некоторые растительные отходы), в некоторых случаях удобно использовать понятие сухой массы, т. е. характеризовать состав абсолютно сухого топлива суммой элементов Сс, Нс, Ос, Nс, Sс и Ас. При этом
Сс + Нс + Ос + Nс + Sс + Ас = 100 %, (1.4)
где индекс показывает, что процентный состав отдельных элементов отнесен к сухой массе.
Для взаимного пересчета массы топлива в соответствии с понятием о массах топлива служат формулы, объединенные в табл. 1.1.
Таблица 1.1. Формулы для пересчета состава топлива с одной массы на другую
|
Заданная масса топлива |
Искомая масса топлива, % |
||
|
рабочая |
сухая |
горючая |
|
|
Рабочая |
1 |
|
|
|
Сухая |
|
1 |
|
|
Горючая |
|
|
1 |
Зольность топлива. Золой называют твердый негорючий остаток, остающийся после сжигания топлива в атмосфере воздуха. Зола может быть в виде сыпучей массы с плотностью в среднем 600 кг/м3 и в виде сплавленных пластин и кусков, называемых шлаками, с плотностью до 800 кг/м3.
В состав золы большинства видов твердого топлива входят: глинозем Al2O3, кремниевая кислота SiO2, известь СаО, магнезия MgO, щелочи Na2O, окислы железа FeO и Fe2О3.
Влажность твердого топлива. Влажность твердого топлива Wрдоходит
до 50 % и более и определяет экономическую целесообразность использования данного горючего материала и возможность его сжигания. Влага снижает температуру в топке и увеличивает объем дымовых газов. Увеличенный объем дымовых газов требует дополнительной энергии на их удаление.
Очевидно, что влага является балластной примесью, так как уменьшает тепловую ценность исходного топлива. Кроме того, часть теплоты, выделяемой топливом при его сгорании, расходуется на испарение влаги.
Летучие вещества. При нагревании твердого топлива без доступа воздуха его органическая масса разлагается, в результате чего образуются газы, водяные и смоляные пары и углесодержащий остаток. Суммарное количество выделяющихся летучих веществ увеличивается с увеличением температуры и времени выдержки, этот процесс в основном заканчивается при 700—800 оС. Выход летучих веществ Vг, в процентах на горючую массу, является важнейшей характеристикой горючей массы твердого топлива и уменьшается по мере увеличения его возраста. Чем больше выход летучих веществ, т.е. чем больше топлива превращается при нагревании в горючий газ, тем проще зажечь это топливо и легче поддерживать устойчивое горение. Органическая часть древесины и горючих сланцев при нагревании без доступа воздуха почти целиком переходит в летучие вещества
(Vг= 85÷90%), в то время как у антрацитов Vг= 3÷4 %. Именно большой выход летучих веществ определяет хорошую горючесть древесины.
Состав некоторых видов твердого топлива представлен в табл. 1.2.
Таблица 1.2. Примерный состав и теплотехнические характеристики горючей массы основных видов твердого топлива
|
Топливо |
Состав горючей массы, % |
Выход летучих веществ, Vг, % |
Низшая теплота сгорания, МДж/кг |
||||
|
Сг |
Sг |
Нг |
Oг |
Nг |
|||
|
Дрова |
51 |
— |
6,1 |
42,2 |
0,6 |
85 |
19 |
|
Торф |
58 |
0,3 |
6 |
33,6 |
2,5 |
70 |
8,12 |
|
Горючий сланец |
60—75 |
4—13 |
7—10 |
12—17 |
0,3—1,2 |
80—90 |
7,66 |
|
Бурый уголь |
64—78 |
0,3—6 |
3,8—6,3 |
15,26 |
0,6—1,6 |
40—60 |
27 |
|
Каменный уголь |
75—90 |
0,5—6 |
4—6 |
2—13 |
1—2,7 |
9—50 |
33 |
|
Полуантрацит |
90—94 |
0,5—3 |
3—4 |
2—5 |
1 |
6—9 |
34 |
|
Антрацит |
93—94 |
2—3 |
2 |
1—2 |
1 |
3—4 |
33 |
Жидкое топливо. Практически все виды жидкого топлива получают путем переработки нефти (бензин, керосин, дизельное топливо и мазут). Мазут представляет собой сложную смесь жидких углеводородов, в состав которых входят в основном углерод (Ср= 84÷86 %) и водород (Нр= 10÷12 %); Ор + Nр= 1÷2 %, содержание воды и зольность не превышают 0,2—1,5%.
Мазуты, полученные из нефти ряда месторождений, могут содержать много серы (до 4,5—5%), что резко усложняет защиту окружающей среды при их сжигании.
Характеристики основных видов жидкого топлива приведены в табл. 1.3. Из указанных выше видов жидкого топлива в промышленных и котельных печах сжигаются только топочные мазуты, которые классифицируются по степени их вязкости: М20, М40, М60, М80, М100 и М120 (цифры в указанных марках мазута означают условную вязкость в градусах Энглера).
Для транспортных установок применяют так называемый мазут флотский марок Ф5 и Ф12.
В табл. 1.4 приведены характеристики топочных и флотских мазутов.
Газообразное топливо. Газообразное топливо по сравнению с другими видами топлива имеет ряд существенных преимуществ: сгорает при небольшом избытке воздуха, образуя продукты полного горения без дыма и копоти; не дает твердых остатков; удобно для транспортировки по газопроводам на большие расстояния и позволяет простейшими средствами осуществлять сжигание в установках самых различных конструкций и мощностей. Газообразное топливо делится на естественное и искусственное. Естественное топливо в свою очередь делится на природное и нефтепромысловое.
Таблица 1.3. Характеристики некоторых видов жидкого топлива, получаемого из нефти
|
Топливо |
Состав горючей массы, % |
Зольность сухого топлива Ас, % |
Влага рабочего топлива Wр, % |
Низшая теплота сгорания рабочего топлива, МДж/кг |
|||
|
углерод Сг |
водород Нг |
сера Sг |
кислород и азот Oг + Nг |
||||
|
Бензин |
85 |
14,9 |
0,05 |
0,05 |
0 |
0 |
43,8 |
|
Керосин |
86 |
13,7 |
0,2 |
0,1 |
0 |
0 |
43 |
|
Дизельное |
86,3 |
13,3 |
0,3 |
0,1 |
Следы |
Следы |
42,4 |
|
Солярное |
86,5 |
12,8 |
0,3 |
0,4 |
0,02 |
Следы |
42 |
|
Моторное |
86,5 |
12,6 |
0,4 |
0,5 |
0,05 |
1,5 |
41,5 |
|
Мазут: |
|||||||
|
малосернистый |
86,5 |
12,5 |
0,5 |
0,5 |
0,1 |
1 |
41,3 |
|
сернистый |
85 |
11,8 |
2,5 |
0,7 |
0,15 |
1 |
40,2 |
|
многосернистый |
84 |
11,5 |
3,5 |
0,5 |
0,1 |
1 |
40 |
Таблица 1.4. Основные характеристики котельных мазутов
|
Показатель |
Нормы по маркам мазута |
||||
|
флотского |
топочного |
||||
|
Ф5 |
Ф12 |
40 |
100 |
200 |
|
|
Вязкость (условная), оВУ, не более: |
|||||
|
при 50 °С |
5 |
12 |
— |
— |
— |
|
при 80 °С |
— |
— |
8 |
15,5 |
|
|
при 100 °С |
— |
— |
— |
— |
6,5—9,5 |
|
Температура застывания °С, не выше |
|||||
|
мазута |
–5 |
–8 |
+10 |
+25 |
+ 36 |
|
мазута из высокопарафиновых нефтей |
— |
— |
+25 |
+42 |
+42 |
|
Температура вспышки, °С, не ниже, при |
|||||
|
определении в тигле: |
|||||
|
закрытом |
80 |
90 |
— |
— |
— |
|
открытом |
— |
— |
90 |
110 |
140 |
Природный газ получают из чисто газовых месторождений, где он выбрасывается из недр земли под давлением, доходящим иногда до 100 атм и более. Основным его компонентом является метан СН4, кроме того, в газе разных месторождений содержатся небольшие количества водорода Н2, азота N2, высших углеводородов СnНm, оксида (СО) и диоксида (СO2) углерода. В табл. 1.5 представлены характеристики горючих газов, входящих в состав газообразного топлива.
Таблица 1.5. Характеристика горючих газов, входящих в состав газообразного топлива
|
Газ |
Химическая формула |
Низшая теплота сгорания 1 м3 газа Qнс |
Плотность газа r, кг/м3, при нормальных условиях |
Удельный объем, м3/кг |
Теоретическая температура горения, °С |
|
|
МДж/м3 |
ккал/м3 |
|||||
|
Водород |
Н2 |
10,8 |
2 580 |
0,09 |
11,112 |
— |
|
Метан |
СН4 |
35,82 |
8 555 |
0,717 |
1,4 |
1 980 |
|
Этан |
С2Н6 |
63,75 |
15 226 |
1,342 |
0,746 |
2 150 |
|
Пропан |
С3Н8 |
91,25 |
21 795 |
1,967 |
1,51 |
— |
|
Бутан |
С4Н10 |
118,65 |
28 338 |
2,593 |
0,385 |
2 080 |
|
Пентан |
C5H12 |
146,08 |
34 890 |
3,218 |
0,321 |
2 090 |
|
Этилен |
С2Н4 |
59,06 |
14 107 |
1,261 |
— |
2 200 |
|
Пропилен |
С3Н6 |
86,00 |
20 541 |
1,915 |
— |
2 270 |
|
Бутилен |
C4H8 |
113,51 |
27 111 |
2,372 |
— |
2 100 |
|
Оксид углерода |
СО |
12,64 |
3 018 |
1,25 |
0,8 |
— |
|
Сероводород |
H2S |
23,38 |
5 585 |
1,5392 |
0,650 |
1900 |
При добыче нефти выделяется так называемый попутный газ, содержащий меньше метана, чем природный, но больше высших углеводородов и поэтому выделяющий при сгорании больше теплоты. Проблема полного его использования сейчас весьма актуальна.
К искусственным газам относят доменный газ, являющийся продуктом при выплавке чугуна на металлургических заводах; коксовый, образующийся при получении кокса в коксовых батареях; светильный, получаемый при сухой перегонке угля; генераторный, получаемый в газогенераторах.
Коксовый и доменный газ используют главным образом на месте в доменном и других цехах металлургического завода.
В табл. 1.6 представлены состав и теплота сгорания некоторых видов газообразного топлива.
Теплота сгорания топлива. Основной характеристикой топлива является так называемая теплота сгорания. Теплотой сгорания твердого и жидкого топлива называется количество тепла, кДж, выделяемое 1 кг топлива при полном его сгорании. Теплоту сгорания обозначают буквой Q и измеряют в килоджоулях на килограмм (кДж/кг) [в системе МКГСС в килокаллориях на килограмм (ккал/кг)].
Теплоту сгорания газообразного топлива относят обычно к 1 м3, взятому при нормальных условиях (0 °С, 760 мм рт.ст.), и измеряют в килоджоулях на метр кубический (кДж/м3).
Таблица 1.6. Состав и теплота сгорания основных горючих газов
|
Газы |
Состав сухого газа, % по объему |
Низшая теплота сгорания газа Qнс , МДж/м3 |
|||||||
|
СН4 |
Н2 |
СО |
СmHn |
O2 |
СО2 |
S |
N2 |
||
|
Природный Коксовый (очищенный) Доменный Сжиженный (ориентировочно) |
94,9 22,5 0,3 4 |
— 57,5 2,7 |
— 6,8 28 |
3,8 1,9 — |
— 0,8 — |
0,4 2,3 10,2 |
— 0,4 0,3 |
0,9 7,8 58,5 |
36,7 16,6 4,0 88,5 |
|
Пропан 79, этан 6, Н — изобутан 11 |
Теплота сгорания зависит от химического состава топлива и условий его сжигания.
В соответствии с понятием органической, горючей и других масс топлива она может быть отнесена к той или другой из этих масс. Наибольший практический интерес представляет теплота сгорания рабочей массы топлива Qнр.
Низшей теплотой сгорания Qнр рабочего топлива называют тепло, выделяемое при полном сгорании 1 кг топлива, за вычетом тепла, затраченного на испарение как влаги, содержащейся в топливе, так и влаги, образующейся от сгорания водорода.
Теплоту сгорания топлива определяют по формулам, учитывающим, что углерод С, водород Н и сера S, участвующие в горении, выделяют определенное количество тепла.
Для определения Qнр используют формулу Д.И. Менделеева, которая дает достаточно точные результаты для самых разнообразных видов топлива.
Формула для определения Qнр, кДж/кг, твердого и жидкого топлива имеет вид
Qнр = 338 Ср+ 1025 Нр– 108,5 (Ор– Sр)– 25 Wр, (1.5)
где коэффициенты выражают теплоту сгорания отдельных горючих элементов, деленную на 100.
Низшую теплоту сгорания сухого газообразного топлива определяют как сумму произведений теплот сгорания горючих газов на их объемное содержание в смеси, кДж/м3:
Qнр = 127 СО + 10 Н2 + 358 СН4 + 591С2Н6 + 911 С3Н8 + 234 Н2S. (1.6)
Условное топливо. Большая разница в теплоте сгорания различных видов топлива затрудняет в некоторых случаях проведение сравнительных расчетов, например, при выявлении запасов топлива, при оценке целесообразности применения разных сортов топлива и пр. Поэтому принято понятие условного топлива. Условным называется такое топливо, теплота сгорания 1 кг или 1 м3 которого равна 29330 кДж (Qусл).
Для перевода действительного топлива в условное пользуются соотношением (безразмерным коэффициентом):
Эк= Qнр /29330 (в системе МКГСС —Эк= Qнр/7000), (1.7)
где Эк — калорийный эквивалент, указывающий какая часть теплоты сгорания условного топлива соответствует низшей теплоте сгорания рассматриваемого топлива (табл. 1.7).
Таблица 1.7. Калорийные эквиваленты различных видов топлива
|
Вид топлива |
Низшая теплота сгорания Qнр, кДж/кг |
Калорийный эквивалент Эк=Qнр/Qусл |
|
Твердое топливо |
||
|
Дрова смешанные |
12 580 |
0,43 |
|
Торф фрезерный |
8460 |
0,29 |
|
Бурый уголь (Подмосковный бассейн) |
10760 |
0,37 |
|
Бурый уголь (Назаровское месторождение) |
13020 |
0,44 |
|
Антрацит АШ (Донецкий бассейн) |
24240 |
0,83 |
|
Сланцы эстонские |
10340 |
0,35 |
|
Жидкое топливо |
||
|
Нефть сырая |
43000 |
1,47 |
|
Мазут М-100 (многосернистый) |
40030 |
1,37 |
|
Мазут М-100 (малосернистый) |
40820 |
1,39 |
|
Газообразное топливо * |
||
|
Природный газ |
34860 |
1,65 |
|
Доменный газ |
3770 |
0,1 |
|
Коксовый газ |
18000 |
1,21 |
|
Генераторный водяной |
10030 |
0,3 |
|
Сжиженный газ (технический пропан) |
93750 |
3,2 |
* Теплота сгорания газообразного топлива, кДж/м3, при нормальных условиях.
Расход условного топлива
Вусл= B Qнр /Qусл , (1.8)
где В — расход рассматриваемого топлива; Qнр — теплота сгорания топлива.
1.2. Расчеты горения топлива
При тепловом расчете топливосжигающих установок (паровых и водогрейных котлов, промышленных огневых печей, двигателей внутреннего
сгорания), а также при обработке результатов их испытаний определяют следующие характеристики и величины:
• теоретический и действительный расходы воздуха V0 и Vд, необходимые для сгорания 1 кг твердого и жидкого топлива или 1 м3 газообразного топлива;
• состав и объем продуктов сгорания Vг (дымовых газов);
• энтальпию дымовых газов при требующихся температурах и коэффициентах избытка воздуха Тг.
Для полного сгорания топлива требуется некоторый избыток воздуха против теоретического расхода. Избыток воздуха характеризуется так называемым коэффициентом избытка aт (иногда называемым коэффициентом расхода воздуха). Он зависит от способа сжигания топлива, качества смесеобразования топлива с воздухом и ряда других факторов.
Коэффициент избытка воздуха представляет собой отношение действительного расхода воздуха к теоретическому, т. е.
aт= Vд/V0. (1.9)
При полном сгорании дымовые газы (продукты сгорания) состоят из СО2 и SО2, получившихся при сгорании углерода и летучей серы, водяного пара, образующегося при испарении влаги топлива и сгорании его водорода, азота, подводимого в топку (камеру сгорания) с воздухом, и, наконец, кислорода, не использованного при горении.
Объем продуктов сгорания определяется по формуле
Vг= VCO2 + VSO2+ VH2O+ VN2+ VO2. (1.10)
При проведении химического анализа дымовых газов содержание СО2 и SO2 определяется совместно, поэтому в расчетные формулы вводится сумма количества СО2 и SO2, обозначаемая символом RO2, тогда
Vг= VRO2+ VN2+ VO2+ VH2O= Vс. г+ VH2O. (1.11)
где Vс. г — объем сухих дымовых газов:
Vс. г= VRO2+ VN2+ VO2. (1.12)
В табл. 1.8 приведены расчетные формулы для определения объемов воздуха и продуктов полного сгорания для твердых, жидких и газообразных видов топлива. В этих формулах Ср, Нр, …; СО, Н2, СН4, … — содержание соответствующих элементов и компонентов в рабочем топливе, %; aт— коэффициент избытка воздуха; dв— влагосодержание сухого воздуха, г/м3 (обычно принимается 10 г/м3).
В случае отсутствия элементарного состава сжигаемого топлива при известном значении Qнр и Wр можно пользоваться эмпирическими формулами
табл. 1.9.
Основой тепловых расчетов топливоиспользующих устройств является энтальпия продуктов сгорания, которую принято рассчитывать на единицу количества топлива, из которого получились эти продукты.
Таблица 1.8. Расчетные формулы для определения объемов воздуха и продуктов полного сгорания при нормальных условиях
|
Определяемые величины |
Для твердого и жидкого топлива, м3/кг |
Для газообразного топлива, м3/м3 |
|
Теоретически необходимое количество воздуха |
V0=[0,0889(Ср+ 0,375Sр)+ 0,2665HP – 0,033Ор]*(1 + 0,00124dв) |
V0= 0,0476[0,5СО+ 0,5Н2+1,5H2S + 2CH4+ ∑(m + n/4)CmHn— O2](1 + 0,00124dв) |
|
Действительное количество воздуха |
Vд= aтV0 |
|
|
Количество продуктов полного сгорания |
VCO2= 0,0187 + Cp; VH2O= 0,112Hp+ 0,00124WP+ 0,0124Vдdв; VSO2= 0,07 Sp ; VO2= 0,21(aт— 1)V0; VN2= 0,008Np + 0,79Vд |
VCO2=(СО + CО2+ СН4+ ∑mCmHn)0,01; VH2O=(H2+ H2S + 2CH4+ CmHn+ 0,124Vдdв)0,01; VSO2= 0,01 H2S; VO2= 0,21 (aт+ l) VO; VN2=(N2+ 79Vд)0,01 |
|
Состав продуктов сгорания, % |
Vг= VCO2+ VH2O+ VSO2+ VO2+ VN2 СО2=(VCO2/ Vг)100 и т.д. |
Таблица 1.9. Эмпирические формулы для определения V0и Vг, м3/кг или м3/м3 при нормальных условиях
|
Топливо |
Теоретически необходимое количество воздуха |
Действительное количество продуктов сгорания |
|
Дрова Уголь Жидкое топливо Газообразное топливо с Qнр< 12 МДж/м3 То же с Qнр> 12 МДж/м3 Коксодоменная печь |
V0= 4,66 (1 – Wp/1000) V0 = 0,24 Qнр+ 0,5 V0= 0,2 Qнр+ 2 V0= 0,21 Qнр V0 = 0,26 Qнр— 0,25 V0 = 0,24 Qнр— 0,2 |
Vг= 5,3 — 4,055Wp/1000 +(a — 1)V0 Vг= 0,21Qнр+ 1,65 +(a — 1)V0 Vг= 0,265 Qнр+(-1)V0 Vг= 0,17 Qнр+ 1 +(a — 1)V0 Vг= 0,27 Qнр+ 0,25 +(- 1)V0 Vг= 0,225 ×+ 0,765 + (a — 1)V0 |
Примечание: Qнр — в МДж/кг или МДж/м3 при нормальных условиях (1 ккал = 4,187 кДж).
Энтальпия продуктов сгорания вычисляется как произведение их объема при нормальных условиях на объемную теплоемкость при постоянном давлении и на температуру, кДж/кг или кДж/м3:
Iг = Vгсгt, (1.13)
где t — температура, оС; Vг —полный объем продуктов сгорания, м3/кг или м3/м3, на единицу топлива; сг — средняя в диапазоне температур 0 — t оС теплоемкость продуктов сгорания, кДж/(кг× оС) или кДж/(м3× оС).
Расчет энтальпии продуктов сгорания, кДж/кг или кДж/м3, производится по формуле
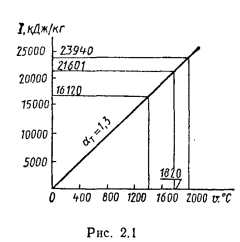
Iг= VCO2(cϑ)CO2+ VSO2(cϑ)SO2+VH2O(cϑ)H2O+VN2(cϑ)N2+VO2, (1.14)
где VCO2, VSO2, VH2O, VN2, VO2— объемы продуктов полного сгорания, определяемые по табл. 1.8; (cϑ)CO2, (cϑ)SO2, (cϑ)H2O,(cϑ) — энтальпии газов, определяемые по температуре (табл. 1.10).
Таблица 1.10. Энтальпия газов и воздуха при различных температурах и постоянном давлении 101 кН/м2 (760 мм рт. ст.), кДж/м3
|
Температура,°С |
(cϑ)CO2 |
(cϑ)H2O |
Сухой воздух |
(cϑ)N2 |
(cϑ)O2 |
(cϑ)H2 |
(cϑ)CO |
(cϑ)SO2 |
|
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
100 |
171 |
150 |
130 |
130 |
132,3 |
129,2 |
130,2 |
182 |
|
200 |
360,6 |
302,4 |
261,9 |
261,6 |
267,2 |
259,6 |
261,5 |
379,4 |
|
300 |
563,9 |
418,7 |
395,7 |
394,6 |
409,4 |
390,6 |
395,7 |
589,5 |
|
400 |
777,1 |
623,4 |
533 |
530,1 |
551,4 |
521,7 |
532,2 |
810,2 |
|
500 |
1001,1 |
600,2 |
672,4 |
667,8 |
699,6 |
654 |
671 |
1037,9 |
|
600 |
1236,4 |
964,3 |
814,7 |
389,4 |
850,8 |
785,9 |
802,2 |
1272,4 |
|
700 |
1475,1 |
1143 |
959 |
950,9 |
1004,5 |
919,5 |
960,7 |
1510,7 |
|
800 |
1718,8 |
1328,9 |
1106,9 |
1098,7 |
1160,5 |
1086,9 |
1110,3 |
1751,8 |
|
900 |
1967,5 |
1526,8 |
1259,4 |
1247,7 |
1320,2 |
1245,3 |
1261,1 |
1997,6 |
|
1000 |
2219,5 |
1721 |
1412,3 |
1399,3 |
1479,7 |
1330,2 |
1414,4 |
2243,8 |
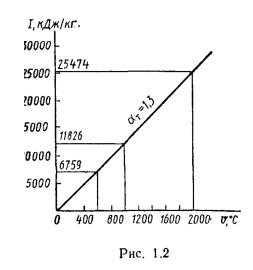
Энтальпию Iгопределяют для нескольких значений ϑ и a. На основании этих подсчетов строят кривые зависимости Iгот ϑ для нескольких a, по которым можно определить объемную энтальпию дымовых газов при заданных температуре и коэффициенте избытка воздуха.
Теплотехника
Теплотехника — это наука о преобразовании энергии в различных процессах, происходящих с макроскопическими телами, и о наиболее общих физических свойствах макроскопических систем.
Если что-то непонятно — вы всегда можете написать мне в WhatsApp и я вам помогу!
Макроскопические тела (системы) — это тела (системы), состоящие из очень большого количества микрочастиц (атомов или молекул). Однако поведение большого количества микрочастиц отличается от поведения каждой отдельной частицы.
Энергия является общим мерилом различных форм движения материи. В то же время, различные формы движения, присущие материальному телу (или системе тел), характеризуются различными видами энергии — механической, тепловой, электрической, химической, магнитной и т. д. — которые являются частью материального тела. При взаимодействии тел происходит как исчезновение той или иной формы энергии (формы движения), так и появление новых форм движения (форм энергии). Опыт показывает, что соотношение числа взаимно преобразованных типов энергии (форм движения, каждая из которых выражается в своих единицах) всегда остается неизменным. Именно этот факт привел к появлению понятия энергии как общей количественной меры движения материи.
Решение задач на тему: Состав топлива
Твердые и жидкие топлива состоят из горючих (углерода — С, водорода — Н, летучей серы — 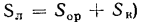
Газообразные топлива состоят из горючих 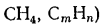
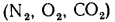
Возможно эта страница вам будет полезна:
При изучении характеристик твердых и жидких топлив и их состава различают рабочую, горючую и сухую массу. Состав рабочей, горючей и сухой массы обозначается соответственно индексами «р», «г» и «с» и выражается следующими равенствами:
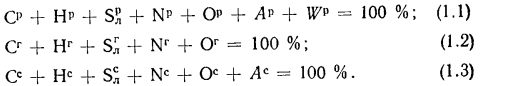
В формулах (1.1), (1.2), (1.3) содержание элементов дано в процентах на 1 кг топлива. Коэффициенты пересчета состава топлива из одной массы в другую приведены в табл. 1.1.
Для сланцев состава 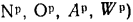
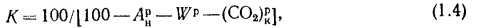
где 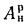
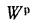
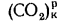
Истинная зольность рабочей массы определяется по формуле
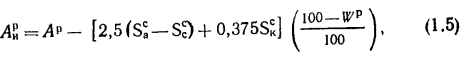

где 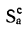
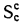
Величина 12,5 (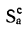
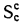
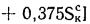
Пересчет состава (%) рабочей массы топлива при изменении влажности производится по формулам

где 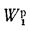
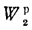
Средний состав (%) смеси двух твердых или жидких топлив, заданных массовыми долями, — первого 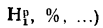
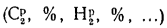
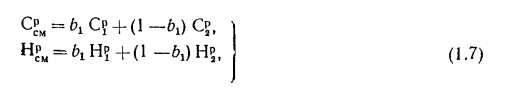
где массовая доля 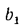

Здесь 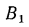
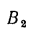
Задача №1
Определить состав рабочей массы челябинского угля марки БЗ, если состав его горючей массы: 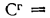
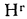
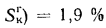
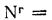
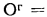
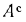
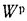
Решение: Пользуясь коэффициентами пересчета из табл. 1.1, определяем зольность рабочей массы топлива
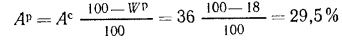
и находим состав рабочей массы топлива:

Для проверки точности вычислений найдем сумму составляющих элементов рабочей массы топлива:
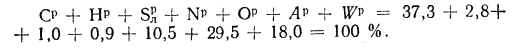
Решение задач на тему: Характеристики топлива
Теплота сгорания топлива. Теплотой сгорания топлива называют количество теплоты в кДж, выделяемой при полном сгорании 1 кг твердого (жидкого) или 1 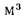
Для твердого и жидкого топлива различают теплоту его рания высшую 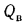
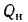
Величины высшей и низшей теплоты сгорания рабочей, горючей и сухой массы твердого (жидкого) топлива связаны выражениями:
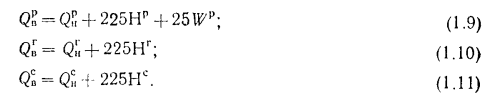
Тепловые расчеты котлов выполняют, пользуясь низшей теплотой сгорания рабочей массы топлива:
- низшая теплота сгорания (кДж/кг) рабочей массы твердого и жидкого топлива
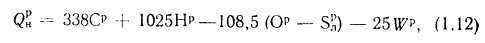
где 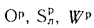
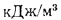
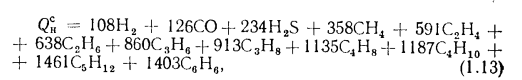
где 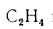
При пересчете низшей теплоты сгорания пользуются следующими формулами: с горючей массы на рабочую и обратно
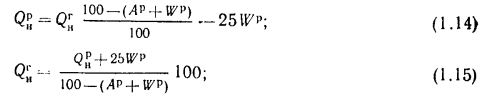
с сухой массы на рабочую и обратно
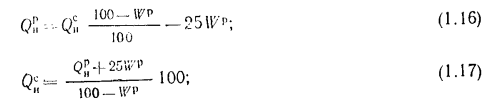
для горючих сланцев — с горючей массы на рабочую и обратно
при изменении влажности
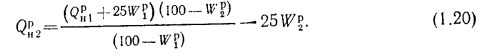
Для смеси двух твердых, жидких или газообразных топлив низшая теплота сгорания определяется по формуле
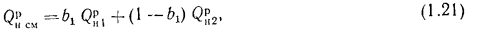
где 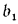
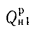
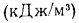
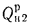
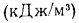
Для сравнения тепловой ценности различных видов топлива пользуются понятием условного топлива.
Условным топливом называют такое топливо, теплота сгорания которого равна 29 300 кДж/кг.
Пересчет расхода натурального топлива на условное осуществляется по формуле

где 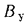
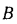

Зольность, влажность и сернистость топлива. При рассмотрении условий работы котлов на различных видах топлива пользуются приведенными величинами зольности 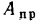
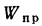
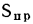

приведенная влажность топлива, (1.25)

приведенная сернистость топлива,

Задача №2
Определить низшую и высшую теплоту сгорания рабочей массы кузнецкого угля марки Д, если состав его горючей массы: 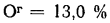
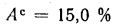
Решение: Пользуясь коэффициентами пересчета из табл. 1.1, определяем зольность рабочей массы топлива
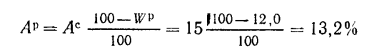
и состав рабочей массы:

Низшую теплоту сгорания рабочей массы топлива определяем по формуле (1 12):
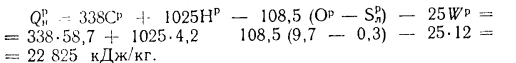
Высшую теплоту сгорания — по формуле (1.9):
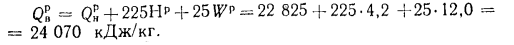
Задача №3
Определить низшую и высшую теплоту сгорания горючей массы высокосернистого мазута, если известны следующие величины: 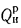
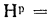
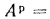
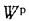
Решение: Содержание водорода в горючей массе определяем, пользуясь коэффициентом пересчета из табл.1.1:
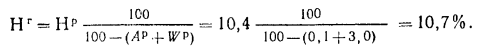
Низшую теплоту сгорания горючей массы топлива находим по формуле (1.15):
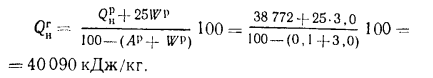
Высшую теплоту сгорания — по формуле (1.10):
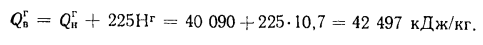
Решение задач на тему: Объем воздуха. Объем и масса продуктов сгорания
Объем воздуха, объем и масса продуктов сгорания определяются на 1 кг твердого, жидкого или на 1 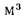
Объем воздуха, необходимый для сгорания топлива. Теоретический (при коэффициенте избытка воздуха в топке 
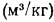
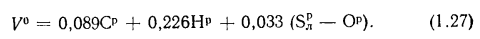
Теоретический объем воздуха 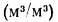
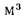
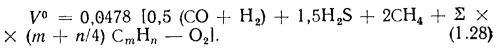
В формуле (1.27) содержание элементов топлива выражается в процентах на 1 кг массы топлива, а в (1.28) содержание горючих газов 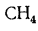
Для сгорания смеси двух твердых, жидких или газообразных топлив теоретический объем сухого воздуха определяется по формуле

где 
Действительный объем воздуха (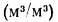

где 
Состав и объем продуктов сгорания топлива. При полном сгорании топлива продукты сгорания содержат газы: 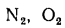
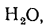
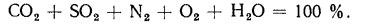
Полный объем продуктов сгорания 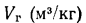
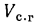

при этом
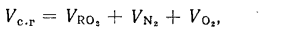
где 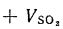
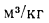
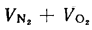
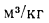
Для твердых (кроме сланцев) и жидких топлив теоретические объемы 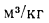

объем двухатомных газов

объем трехатомных газов
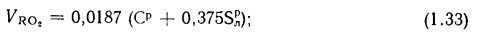
объем сухих газов
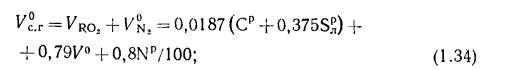
объем водяных паров
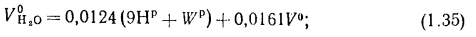
полный объем продуктов сгорания
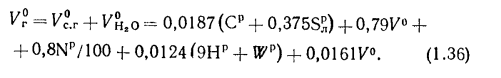
Для сланцев объем трехатомных газов определяется по формуле
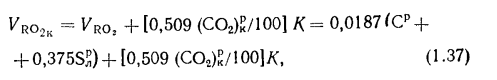
где К — коэффициент разложения карбонатов: при слоевом сжигании К = 0,7, при камерном — 1,0.
Для газообразного топлива теоретические объемы продуктов сгорания 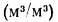

объем двухатомных газов

объем трехатомных газов
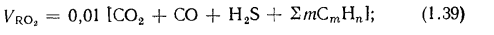
объем сухих газов

объем водяных паров
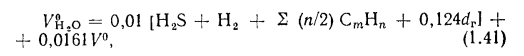
где 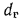
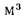
полный объем продуктов сгорания

Для твердых (кроме сланцев), жидких и газообразных топлив объемы продуктов полного сгорания (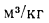

объем сухих газов
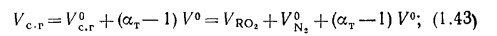
объем водяных паров

полный объем продуктов сгорания определяется по (1.31).
Для сланцев полный объем продуктов сгорания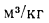

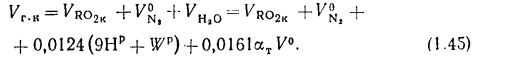
Содержание (%) 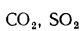
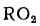

Максимальное содержание (%) трехатомных газов 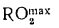

где 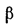
для твердого и жидкого
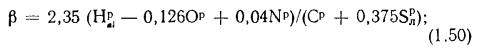
для газообразного
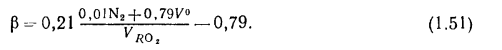
Содержание (%) азота 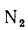
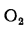

Масса продуктов сгорания:
для твердого (кроме сланцев) и жидкого топлива (кг/кг)
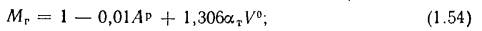
для газообразного топлива
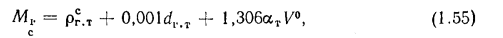
где 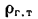
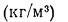
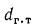
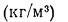
для сланцев (кг/кг)
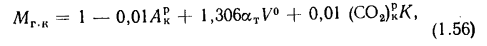
где 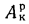
Расчетное содержание (%) золы в топливе с учетом неразложившихся карбонатов

Для твердых топлив концентрация золы в продуктах сгорания определяется по формуле

где 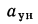
Коэффициент избытка воздуха в топке. При полном сгорании топлива коэффициент избытка воздуха в топке определяется по формуле

где 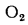
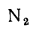
Возможно эта страница вам будет полезна:
Задача №4
Определить объем продуктов полного сгорания на выходе из топки, а также теоретический и действительный объемы воздуха, необходимые для сгорания 1 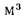
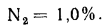

Решение: Теоретический объем воздуха, необходимый для полного сгорания 1 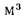
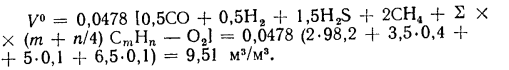
Действительный объем воздуха — по формуле (1.30):
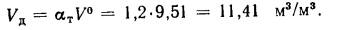
Объем сухих газов при 
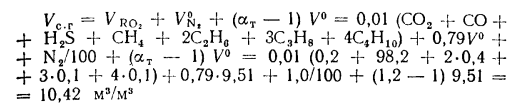
Объем водяных паров при 
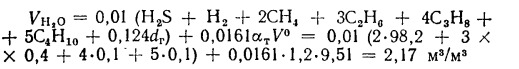
Объем продуктов полного сгорания — по формуле (1.31):
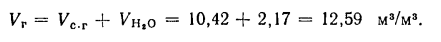
Задача №5
Определить на выходе из топки объем продуктов полного сгорания 1 кг карагандинского угля марки К состава: 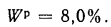

Решение: Теоретический объем воздуха, необходимый для полного сгорания 1 кг топлива, определяем по формуле (1.27):
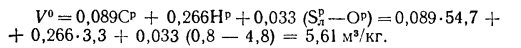
Объем сухих газов при 
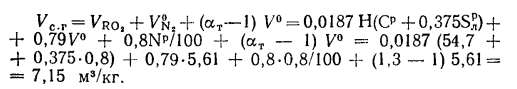
Объем водяных паров при 
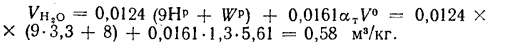
Объем продуктов полного сгорания находим по формуле (1.31):
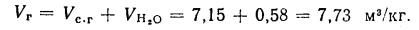
Примеры решения задач по всем темам теплотехники
Теплотехника — это наука, изучающая преобразование различных видов энергии друг в друга.
В настоящее время теплотехника разделена на три части:
- Общая термодинамика (физическая) — изучает преобразование энергии в твердые, жидкие и газообразные тела, излучение различных тел, магнитные и электрические явления, а также устанавливает математическую связь между термодинамическими значениями.
- Химическая термодинамика — исследования, основанные на законах общей термодинамики, химических, тепловых, физических и химических процессов, равновесия и влияния внешних факторов на равновесие.
- Техническая термодинамика — изучение закономерностей преобразования тепла в работу.
Энтальпия продуктов сгорания (
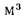
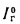

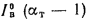
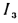
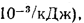
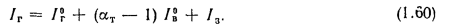
Энтальпия продуктов сгорания (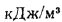
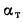
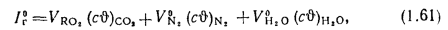
где 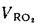
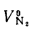
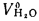
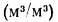
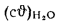
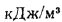
Энтальпия воздуха (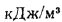
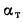
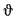

где 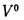
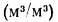
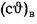
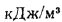

где 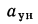
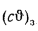
Значения энтальпий продуктов полного сгорания топлива, воздуха и золы приведены в табл. 1 (см. Приложение}.
Задача №1
Определить энтальпию продуктов сгорания на выходе из топки, получаемых при полном сгорании 1 кг карагандинского угля марки К состава:
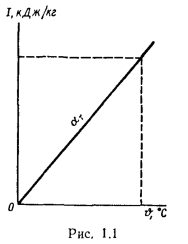
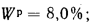
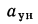
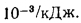
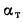
Решение: Теоретически необходимый объем воздуха определяем но формуле (1.27):
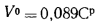
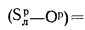
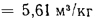
Объем трехатомных газов находим по формуле (1.33):
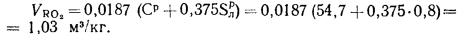
Теоретический объем азота определяем по формуле (1.32):
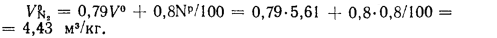
Теоретический объем водяных паров находим по формуле (1.35):
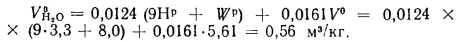
Энтальпию продуктов сгорания при 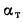
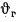
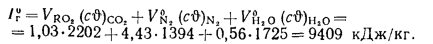
Значения 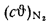
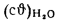
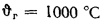
Энтальпию золы 1 кг угля при 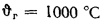
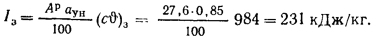
Значение 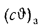
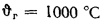
Энтальпию воздуха при 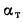
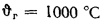
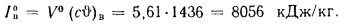
Значение 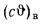
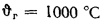
Энтальпию продуктов полного сгорания 1 кг угля при 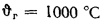
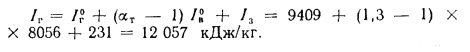
Задача №2
В топке котла сжигается 1 кг карагандинского угля марки К состава: 
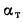
Решение: Теоретически необходимый объем воздуха определяем по формуле (1.27):
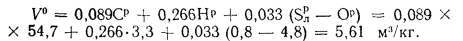
Объем трехатомных газов находим по формуле (1.33):
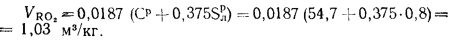
Теоретический объем азота определяем по формуле (1.32):
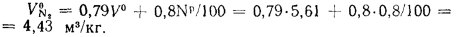
Теоретический объем водяных паров находим по формуле (1.35):
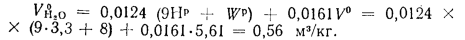
Энтальпию продуктов сгорания 1 кг угля при 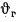
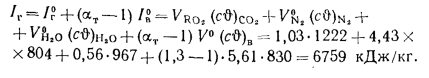
Значения 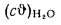
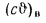
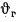
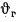
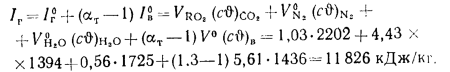
Значения 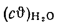
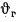
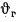
По найденным значениям энтальпий продуктов сгорании троим 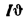
Полезное тепловыделение в топке (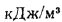
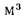
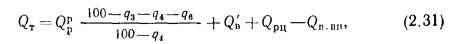
где 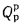
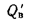
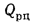
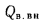
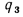
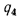
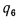
Теплота, вносимая в топку с поступающим холодным или горячим воздухом:
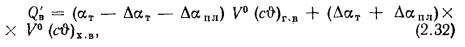
где 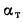
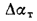
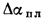
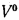
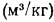
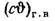
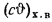
Теплота рециркулнрующнх газов

где 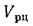
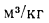
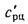
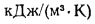
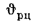
Теплота, вносимая в топку воздухом, подогретым вне котлоагрегата, 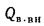
Коэффициент сохранения теплоты

где 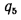
Теоретическая температура горения топлива в топке 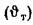
Зная полезное тепловыделение 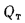
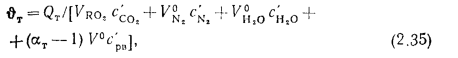
где 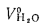
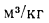
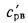
В формуле (2.35) неизвестны значения 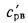
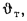
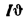
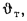
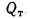
Температура газов (°С) на выходе из топки
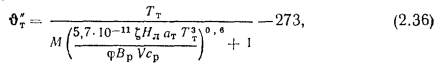
где 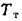
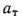
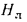
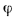
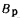
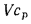
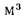
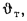
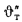
Лучевоспринимающая поверхность 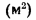
Возможно эта страница вам будет полезна:
Задача №3
Определить теоретическую температуру горения топлива в топке котельного агрегата, работающего: на донецком угле марки Д состава: 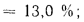
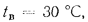
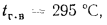
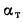
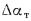
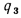
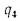
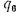
Решение: Низшую теплоту сгорания рабочей массы топлива определяем но формуле (112):
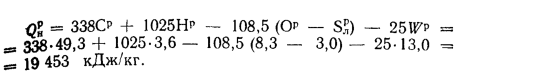
Теоретически необходимый объем воздуха находим по (1.27):
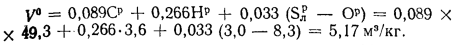
Теплоту, вносимую в топку воздухом, подогретым вне котлоагрегата, определяем по формуле (2.7):
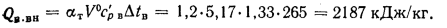
Располагаемую теплоту находим по формуле (2.3):
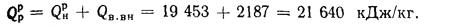
Теплоту, вносимую в топку с воздухом, определяем по (2.32):
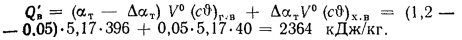
Значения энтальпий 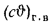
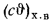
Полезное тепловыделение в топке находим по формуле (2.31):
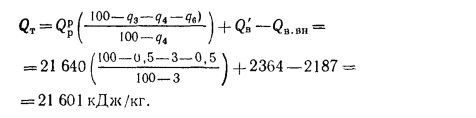
Зная полезное тепловыделение в топке, определяем теоретическую температуру горения с помощью 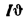
Объем трехатомных газов определяем по формуле (1.33):
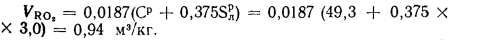
Теоретический объем азота находим по формуле (1.32):
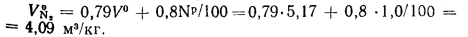
Теоретический объем водяных паров определяем по формуле (1.35):
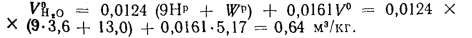
Энтальпию продуктов сгорания при 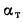
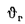
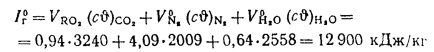
Значения энтальпий 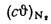
Энтальпию воздуха при 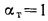
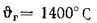
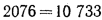
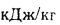
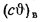
при
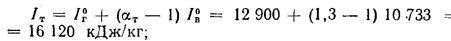
при
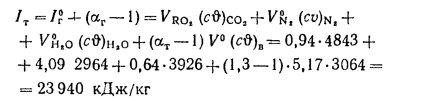
По найденным значениям энтальпий продуктов сгорания строим 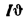
С помощью диаграммы по полезному тепловыделению в топке 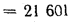
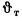
Задача №4
Определить, на сколько изменится теоретическая температура горения в топке котельного агрегата за счет подачи к горелкам предварительно подогретого воздуха, если известны температура воздуха в котельной 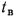
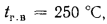
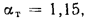
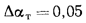
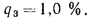
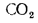
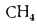
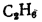
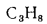
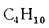
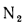
Решение: Низшую теплоту сгорания рабочей массы определяем по формуле (1.13):
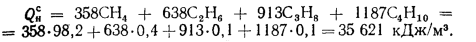
Теоретически необходимый объем воздуха находим по (1.28):
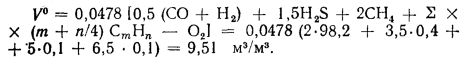
Теплоту, вносимую в топку воздухом, подогретым вне котлоагрегата, определяем по формуле (2.7):
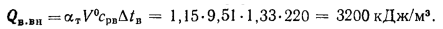
Располагаемую теплоту находим по формуле (2.3):
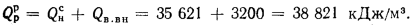
Теплоту, вносимую в топку с воздухом, — по формуле (2.32):
Значения энтальпий 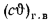
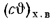
Полезное тепловыделение в топке при подаче к горелкам подогретого воздуха находим по формуле (2.31):
Полезное тепловыделение в топке при подаче к горелкам воздуха без предварительного подогрева определяем, пользуясь формулой (2.31):
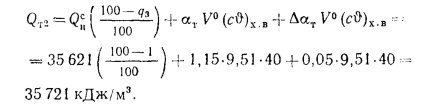
Зная полезные тепловыделения в топке, находим теоретические температуры горения с помощью
-диаграммы.
Для этого задаем два значения температуры газов (1400 и 2000 °С) и вычисляем для них энтальпии продуктов сгорания.
Объем трехатомных газов находим по формуле (1.39):
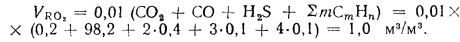
Теоретический объем азота определяем по формуле (1.38):
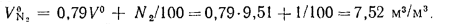
Теоретический объем водяных паров находим по формуле (1.41):
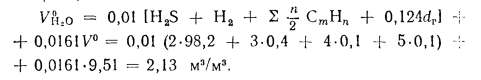
Энтальпию продуктов сгорания при aT — 1 и 0Г —= 1400 °С определяем по формуле (1.61):
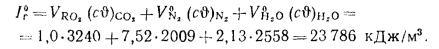
Энтальпию воздуха при 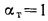
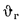
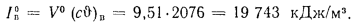
Энтальпию продуктов сгорания находим по формуле (1.60):
при 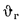
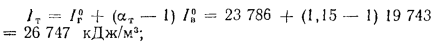
при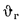
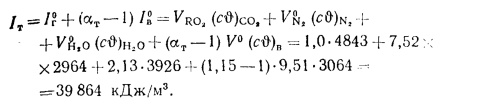
По найденным значениям энтальпий продуктов сгорания строим 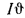
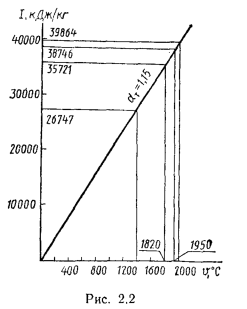
С помощью диаграммы полезным тепловыделениям в топке 
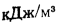

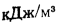
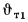
Теоретическая температура горения в топке котлоагрегата за счет подачи к горелкам подогретого воздуха изменится на
Задача №5
Расчет конвективных поверхностей нагрева котельного агрегата
Пароперегреватели. Количество теплоты (кДж/кг), воспринятой паром в пароперегревателе, определяется по формуле
где 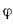
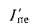
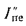
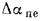
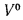
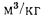
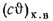
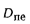
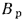
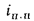
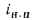
Конвективная поверхность 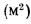

где 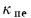
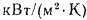
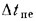
Температурный напор как для прямотока, так и для противотока определяется как среднелогарифмическая разность температур:

где 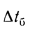
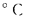
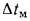
Если 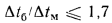

Экономайзеры. Количество теплоты (кДж/кг), воспринятой водой в экономайзере, определяется по формуле
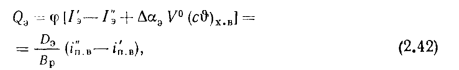
где 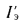
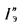
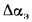
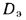
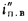
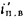
Расход воды через экономайзер

где Р — величина непрерывной продувки, %.
Энтальпия воды на выходе из экономайзера

Конвективная поверхность 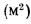

где 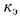
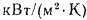
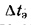
Воздухоподогреватели. Количество теплоты (кДж/кг), воспринятой воздухом в воздухоподогревателе, определяется по формуле
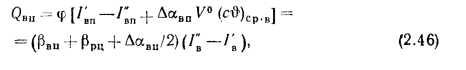
где 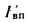
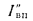
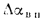
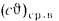
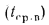
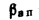
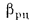
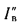
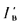

где 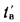
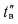
Отношение объема воздуха на выходе из воздухоподогревателя к теоретически необходимому

где 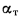
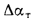
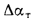
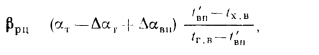
где 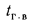
Конвективная поверхность (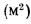

где 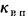
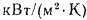
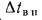
Задача №6
Определить энтальпию продуктов сгорания на выходе из пароперегревателя котельного агрегата пар»-производительностью D = 3,89 кг/с, работающего на природном газе Саратовского месторождения с низшей теплотой сгорания 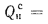
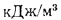
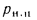
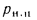
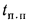
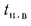
Вличина, непрерывной продувки P 4 %, к.п.д. котлоагрегата (брутто) 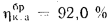
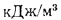
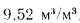
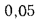
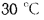
Решение: Расчетный расход топлива определяем по формуле (2.25):
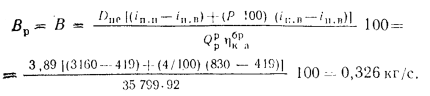
Количество теплоты, воспринятой паром в пароперегревателе, находим по формуле (2.38):
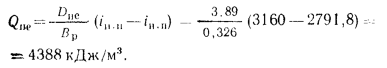
Энтальпию насыщенного пара при давлении 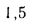
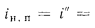
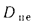
Коэффициент сохранения теплоты определяем по формуле (2.31):
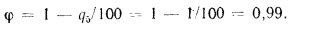
Энтальпию продуктов сгорания на выходе из пароперегревателя находим из формулы (2.38):
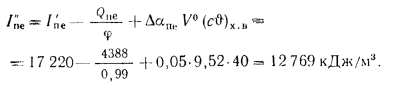
Задача №7
Определить количество теплоты, воспринятой. водой, конвективную поверхность нагрева экономайзера котельного агрегата паропроизводительностью D = 5,45 кг/с работающего на донецком каменном угле марки Т с низшей теплотой сгорания 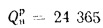
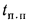
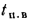
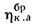
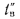
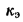
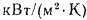
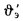
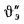
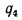
Решение: Натуральный расход топлива определяем по формуле (2.25):
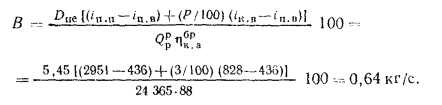
0
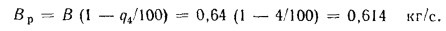
Расход воды через экономайзер определяем по формуле (2.43):
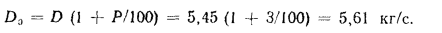
Количество теплоты, воспринятой водой в экономайзере, находим по формуле (2.42):

Температурный напор в экономайзере определяем по формуле (2.40):
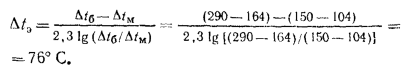
инвективную поверхность нагрева экономайзера по формуле (2.45):
Задача №8
Определить максимально допустимый зотовый износ стенки углеродистой трубы воздухоподогревателя котельного агрегата и температуру точки росы продуктов сгорания, если известны коэффициент, учитывающий абразивные свойства золы, 

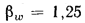
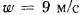
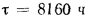
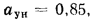
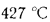
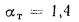
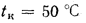
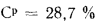
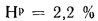
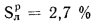
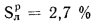
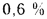
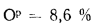
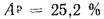
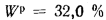
Решение: Низшую теплоту сгорания рабочей массы топлива определяем по формуле (I.I2):
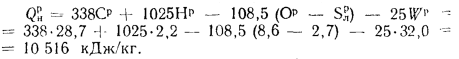
Теоретический объем воздуха, необходимый для полного сгорания 1 кг топлива, определяем по формуле (1.27):
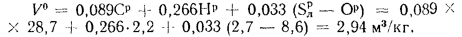
Объем сухих газов при 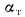
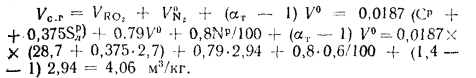
Объем водяных паров при 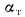
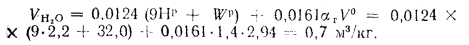
Объем продуктов полного сгорания находим по формуле (1.31):
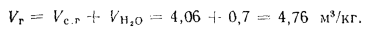
Концентрацию золы в продуктах сгорания определяем (2.51):
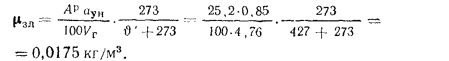
Изл
Приведенную зольность топлива находим по формуле (1 .24):
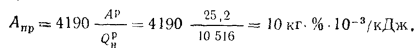
Приведенную сернистость топлива — по формуле (1.26):
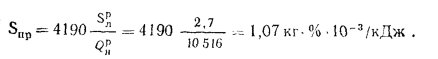
Максимально допустимый золовый износ стенки трубы находим по формуле (2.50):
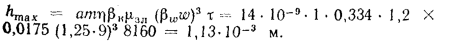
Температуру точки росы продуктов сгорания определим формуле (2.52):
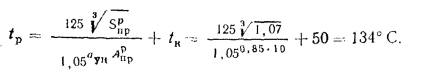
Расчет дымовой трубы на рассеивание в атмосфере загрязняющих веществ состоит в проверке высоты трубы на рассеивание в атмосфере золы, оксидов азота и диоксида серы 
При котором их концентрация у поверхности земли будет меньше предельно допускаемой санитарными нормами.
Предельно допускаемая концентрация (п. д. к.) не должна превышать для золы и диоксида серы значения 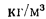
Концентрация загрязняющих веществ 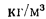
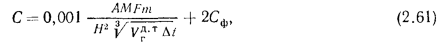
где А — коэффициент стратификации атмосферы, 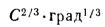
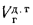
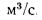
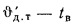
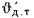
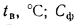
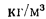
Масса золы (кг/с), выбрасываемой в атмосферу из дымовой трубы

где n — число котлоагрегатов, подсоединенных к трубе; 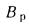
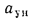
Масса диоксида серы (кг/с), выбрасываемого в атмосферу из дымовой трубы:

где 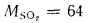
Задача №9
Определить концентрацию диоксида серы у поверхности земли для котельной, в которой установлены два одинаковых котлоагрегата. Работающих на высокосернистом мазуте состава: 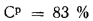
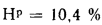
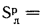
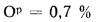
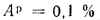
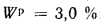
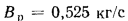
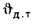
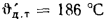
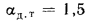
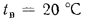
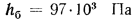
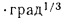
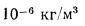
Решение: Теоретически необходимый объем воздуха определяем по формуле (1.27):
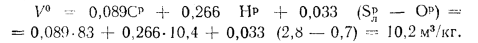
Теоретический объем продуктов полного сгорания находим по формуле (1.36):

Объем дымовых газов проходящих через дымовую трубу, определяем по формуле (2.57):
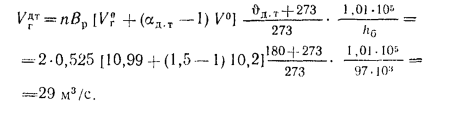
Массу диоксида серы, выбрасываемого в атмосферу из дымовой трубы, находим по формуле (2.63):
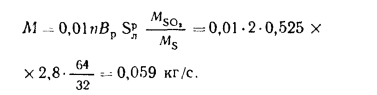
Концентрацию оксида серы у поверхности земли определяем по формуле (2.61):