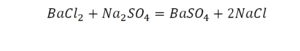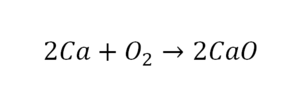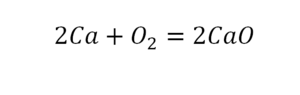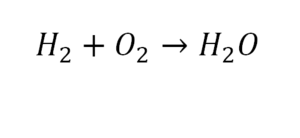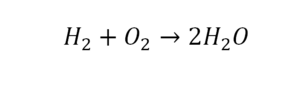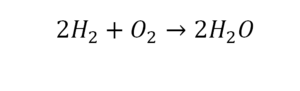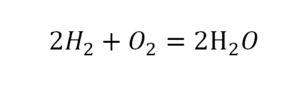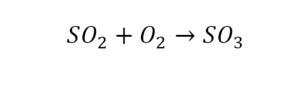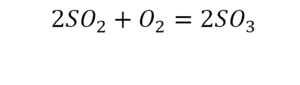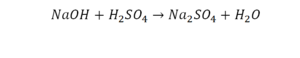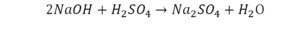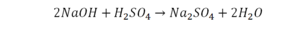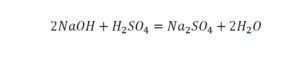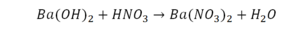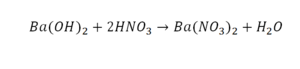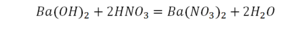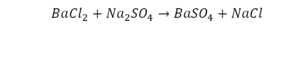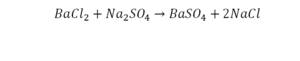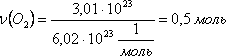Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
Число атомов, формула
Зная массу атома mа, можно вычислить число атомов в любой массе вещества.
Если
| N | число атомов определенного вещества, | |
|---|---|---|
| m | масса этого вещества, | кг |
| M | атомная масса, |
то, поскольку N = m/mа, получаем
[ N = frac{m}{M cdot 1 enspace а. е. м.} = frac{m}{M cdot 1.66057 cdot 10^{-27} enspace кг} ]
В большинстве случаев достаточно вместо точной атомной массы М в данной формуле использовать массовое число А.
Вычислить, найти число атомов в веществе по формуле 1
Число атомов |
стр. 738 |
|---|
Как определить количество атомов в молекуле?
Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Расчёты по уравнениям химических реакций.
Стехиометрия – количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими.
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими.
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
Моль – это такое количество вещества, в котором содержится определённое число частиц (молекул, атомов, ионов), равное постоянной Авогадро:
Выход реакции η – отношение реальной массы продукта mp к теоретически возможной mт, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
1. Составим уравнение химической реакции:
2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам:
3. Определим молярную массу магния:
Относительная атомная масса магния Ar(Mg) = 24.
Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M(Mg) = 24 г/моль.
4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO, масса которого неизвестна, ставим x моль, над формулой магния Mg пишем его молярную массу:
6. Составим пропорцию:
По правилам решения пропорции:
Количество оксида магния ν(MgO) = 1 моль.
http://liveposts.ru/articles/education-articles/himiya/koeffitsienty-i-indeksy-v-himicheskih-uravneniyah
http://www.calc.ru/Raschty-Po-Uravneniyam-Khimicheskikh-Reaktsiy.html
Для
определения числа атомов (молекул) в
определенном количестве вещества
необходимо воспользоваться следующей
формулой: N = ν · NA,
где
N — число частиц (атомов или молекул).
Например,
определим количество атомов алюминия,
содержащиеся в 2 моль вещества алюминия:
N (Al) = ν (Al) · NA.
N
(Al) = 2 моль · 6,02 · 1023
= 12,04 · 1023
(атомов).
Кроме того, можно определить
количество вещества по известным числом
атомов (молекул):
.
Например,
определим количество вещества
молекулярного кислорода, которая
содержит 3,01 · 1023
молекул кислорода:.
.
.
Количество вещества определяется числом
структурных единиц (атомов, молекул,
ионов или других частиц) этого вещества.
Количество вещества обозначается
буквой.
9.
Уравнение Менделеева- Клайперона.
PV=(m/M)RT,
где R-
универсальная газовая постоянная,
равная 8,31 Дж/(К*моль)
10.
Эквивалент. Закон эквивалентов.
Эквивалент-
часть вещества, реагирующая без остатка
с одним эквивалентом водорода или вообще
с одним эквивалентом любого другого
вещества.
Закон
эквивалентов: «Вещества
взаимодействуют друг с другом в
эквивалентных количествах» , или «массы
реагирующих веществ пропорциональны
их эквивалентам либо эквивалентным
массам (объемам): m1/m2=
Э1/Э2».
11.
Значения эквивалентов водорода и
кислорода.
Эm(Н2)=1
г/экв
Эm(О2)=
8 г/экв
12.
Молярная масса эквивалента, молярный
объем эквивалента.
Молярная
масса эквивалента элемента в соединении
не является величиной постоянной,
зависит от валентности элемента в данном
соединении и выражается уравнением:

где
М – молярная масса элемента, г/моль; Z –
валентность элемента в данном соединении;
1/z – фактор эквивалентности
Эквивалентный
объем или объем моля эквивалента Vэ(X)
– это объем, который занимает один моль
эквивалентов газообразного вещества
при нормальных условиях (н.у.).
13.
Эквивалент кислоты, основания, соли.
Кислоты:
определяется отношением Mr
основания к числу атомов водорода в
формуле кислоты, способных заместиться
на металл (основность кислоты). Например
эквивалент серной кислоты Н2SO4=
98/2= 49 (1/2*М)
Основания:
определяется отношением Mr
основания к числу гидроксильтных групп
ОН в формуле основания, способных
заместиться на кислотный остаток
(кислотность основания). Например,
эквивалент едкого натра равен ЭNaOH=
40/1= 40, т.е. у этого вещества значения
эквивалента и молекулярной массы
совпадают. (1/3*М)
Соли:
определяется как частное от деления Mr
соли на суммарный заряд катионов. Так,
эквивалент сульфата аллюминия ЭAl2SO4=
342/6= 57. (М/ сумм. Заряд)
Оксида:
равен сумме эквивалентов кислорода и
элемента, образующего данный оксид.
Например, эквивалент оксида аллюминия
равен: Al2O3=
ЭAl+
ЭО. Поскольку алюминий трехвалентен,
то ЭAl=
ArAl/B=
27/3=9, следовательно, ЭAl2O3=
9+8=17. Тоже получим, разделив Mr
оксида на суммарный заряд катионов
металла: 102/6=17.
14.
Закон Авогадро. Следствия из закона
Авогадро.
Закон:
«В равных объемах любых газов при
одинаковых условиях содержится одинаковое
число молекул» .
Следствия:
—
одинаковое число молекул различных
газов при одинаковых условиях ( давлении
и температуре) занимает одинаковый
объем.
—
один моль любого газа при определенных
условиях занимает постоянный объем.
15.
Строение атома: модель Томпсона.
В
атоме Томсона положительное электричество
«размазано» по сфере, в которую вкраплены,
как изюм в пудинг, электроны. В простейшем
атоме водорода электрон находится в
центре положительно заряженной сферы.
При смещении из центра на электрон
действует квазиупругая сила
электростатического притяжения, под
действием которой электрон совершает
колебания. Частота этих колебаний
определяется радиусом сферы, зарядом
и массой электрона, и если радиус сферы
имеет порядок радиуса атома, частота
этих колебаний совпадает с частотой
колебания спектральной линии атома. В
многоэлектронных атомах электроны
располагаются по устойчивым конфигурациям,
рассчитанным Томсоном. Томсон считал
каждую такую конфигурацию определяющей
химические свойства атомов. Он предпринял
попытку теоретически объяснить
периодическую систему элементов Д. И.
Менделеева. Эту попытку Бор позднее
назвал «знаменитой» и указал, что со
времени этой попытки «идея о разделении
электронов в атоме на группы сделалась
исходным пунктом и более новых воззрений».
Отметив, что теория Томсона оказалась
несовместимой с опытными фактами, Бор
тем не менее считал, что эта теория
«содержит много оригинальных мыслей и
оказала большое влияние на развитие
атомной теории».
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
To calculate the number of atoms in a formula, the weight of a sample, its atomic mass from the periodic table and a constant known as Avogadro’s number are needed.
Step 1: Find the Molar Mass of the Formula
Find a periodic table of elements to find the molar mass of your sample. If your sample is made of one element, like copper, locate the atomic mass on the periodic table. Atomic mass is usually listed below the symbol for that element.
The atomic mass of Copper is 63.55 atomic mass units. This formula mass is numerically equal to the molar mass in grams/mole, and this means copper is 63.55 grams/mole.
Whether you use an individual element like copper or a molecule, the procedure for finding the atoms in a formula remains the same.
Example: How many atoms are present in 32.80 grams of copper?
Find the molar mass of copper on the periodic table: 63.55 grams/mole.
Understanding the Mole: The mole (often abbreviated as mol) listed above is a unit of measurement. If you sold eggs, you would talk about them in the dozens, not one by one.
A mole is a certain amount, too. If chemists want to speak about incredibly small atoms and molecules, an amount far greater than a dozen is needed. A mole is Avogadro’s number of items: 6.022 × 1023.
- 1 mole of Cu atoms = 6.022 × 1023 Cu atoms
- 1 mole of S atoms = 6.022 × 1023 S atoms
- 1 mole of Cu2S molecules = 6.022 × 1023 Cu2S molecules
- 1 mole of pennies = 6.022 × 1023 pennies
To give an idea of how large this number is, 1 mole of pennies would be enough money to pay all the expenses of each country on earth for about the next billion years.
Step 2: Find the Number of Moles
The example is 32.80 grams of Cu. Change that into moles using the molar mass you found in Step 1. Chemists use ratios for this calculation.
Start with what you know and add in the molar mass ratio, so the units will cancel:
32.80 g of Cu × 1 mol Cu / 63.55 g Cu = 0.52 mol of Cu
Step 3: Convert Moles to Atoms Using Avogadro’s Number
Once the amount of moles is known, the number of atoms in the formula may be calculated using Avogadro’s number. Again, use the ratio format.
Notice the number of moles is used from Step 2 to start the calculation from moles to atoms:
0.52 mol of Cu × 6.022 x 1023 atoms / 1 mol of Cu = 3.13 x 1023 molecules
To answer your example question, there are 3.13 × 1023 atoms in 32.80 grams of copper.
Steps 2 and 3 can be combined. Set it up like the following:
32.80 g of Cu × 1 mol Cu / 159.17 g Cu × 6.022 x 1023 atoms / 1 mol of Cu = 3.13 x 1023 atoms in 32.80 grams of copper
Several online sites have a number of atoms calculator. One is the Omni Calculator and is listed in the Resources section, but you’ll still need to know how to calculate molar mass (Step 1).
Historical Note: Why Is It Called Avogadro’s Number?
Avogadro’s number is named after Amedeo Avogadro (1776-1856), an Italian scientist that hypothesized that equal volumes of gases at the same temperature and pressure will have the same number of particles.
Avogadro did not propose the constant, 6.022 ×1023, but because of his contributions to science, the constant was named after him. Incidentally, Avogadro first introduced his gas theory in 1811, and it was ignored for 50 years.