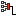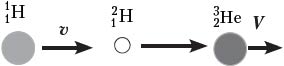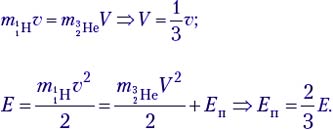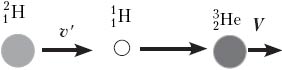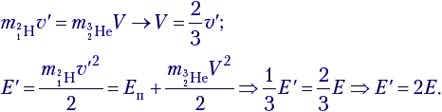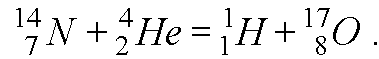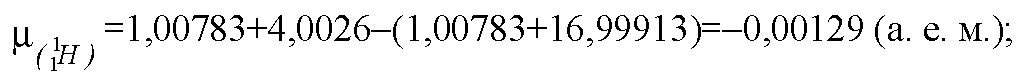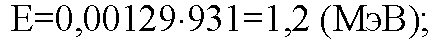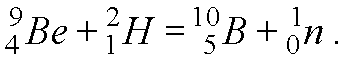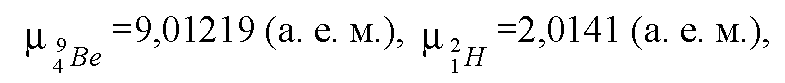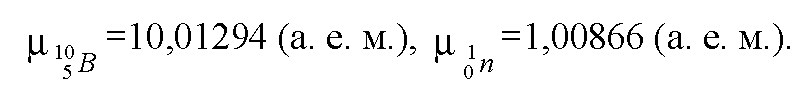Тема: Найти энергию, выделяющуюся при реакции (Прочитано 95389 раз)
0 Пользователей и 1 Гость просматривают эту тему.
Найти энергию, выделяющуюся при реакции 37Li + 11H => 24He + 24He.
« Последнее редактирование: 20 Января 2015, 15:36 от Сергей »
Записан
Решение.
В данной задаче необходимо определить энергетический выход ядерной реакции:
37Li + 11H => 24He + 24He.
Энергетический выход ядерной реакции определяется по формуле:
∆Е = ∆m а.е.м.∙931,5 МэВ/а.е.м. (1).
∆m – изменение массы.
∆m = m1 – m2 (2).
m1 – масса ядер до реакции, m2 – масса ядер после реакции.
m1 = m(37Li) + m(11Н) = 7,01601 а.е.м. + 1,00783 а,е.м. = 8,02384 а,е.м.
m2 = m(24Не) + m(24Не) = 4,00260 а.е.м. + 4,00260 а,е.м. = 8,0052 а,е.м.
∆m = 0,01864 а.е.м.
∆Е = 17,36 МэВ.
« Последнее редактирование: 15 Февраля 2015, 07:21 от alsak »
Записан
Задачи, тесты
А. А.
Найдин,
< naidin_anatoli@mail.ru >, МОУ гимназия № 44, г. Новокузнецк, Кемеровская обл.
Расчёт энерговыделения при ядерной реакции
Всё прекрасное так же трудно, как и редко…
Спиноза
Расчёт энерговыделения при ядерных реакциях традиционно труден для учеников средней школы, однако происходящие внутри атомного ядра процессы всегда вызывают у них живой интерес. В школьных учебниках на примерах показано, как определить энергию связи ядра и энергетический выход ядерной реакции, однако совсем не обсуждаются условия протекания ядерной реакции и другие способы расчёта энерговыделения. Попробуем этот недочёт устранить, сгруппировав решаемые на уроке задачи так, чтобы они образовали систему задач, которая будет развивать ученика. Напомним, что ядерные реакции – превращения атомных ядер при взаимодействии с частицами, в том числе с фотонами или друг с другом.
Для протекания ядерной реакции необходимо сближение частиц до расстояний порядка 10–13 см. Что конкретно произойдёт с ядром, зависит от энергии налетающей частицы и энергии связи нуклонов: частица может быть захвачена ядром атома и вызвать ядерную реакцию, может расщепить ядро на фрагменты, может отлететь от ядра при упругом ударе. Ядерные реакции подчиняются законам сохранения электрического заряда, энергии, импульса.
Примеры ядерных реакций (запись комментируют учащиеся):
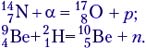
Ядерные реакции могут протекать как с выделением, так и с поглощением энергии. Причём эта энергия по порядку величины в 106 раз больше, чем при химической реакции! Произведём расчёт энерговыделения на примере ядерной реакции:
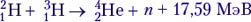
(такие ядерные реакции называются реакциями синтеза):
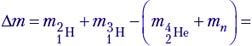
E = Δmc2 = 0,28221 · 10–11 Дж ≈ 17,6 МэВ.
Ядерные реакции деления покажем на примере одной из возможных схем деления изотопа урана 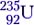
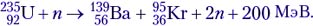
Эта реакция идёт при взрыве атомной бомбы, а также в недрах ядерного реактора. Расчёт энерговыделения производить не будем, но на будущее будем знать, что в среднем на одну реакцию деления изотопа урана выделяется около 200 МэВ энергии.
Реакцию распада удобно показать на примере реакции 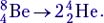
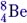
Сокращённую запись уравнения ядерной реакции покажем на примере реакции 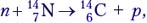
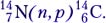
«Установленное Эйнштейном соотношение является основанием для дальнейших, значительно более важных выводов. Радиоактивная отслойка является с этой точки зрения одной из возможностей получения из материи огромных запасов энергии, техническое использование таких запасов энергии в принципе не представляется невыполнимым и совсем недавно Резерфорд получил, по-видимому, подобные количества энергии, – правда, в микроскопическом масштабе, когда ему удалось разложить азот путём радиоактивного расщепления. Но не нужно предаваться иллюзии, будто техническая добыча указанной здесь энергии является вопросом непосредственного будущего и что этим будет достигнуто обесценивание угля; с другой стороны, нельзя возражать и против того, что тут раскрывается одна из серьёзнейших технических проблем».
В.Нернст, 1918
Теперь в процессе решения задач ученикам можно продемонстрировать и другие методы расчёта энерговыделения при ядерной реакции.
«Прибавь ещё один оттенок к радуге…»
У.Шекспир
Задача 1. Одной из наиболее известных реакций термоядерного синтеза является реакция слияния дейтерия и трития: 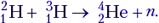
Решение. В данной реакции происходит разделение ядер дейтерия и трития на составляющие их частицы, на что затрачивается энергия связи, после чего образуется ядро гелия с выделением энергии. Энергетический выход реакции: Е = 28,294 МэВ – (2,228 МэВ
+ 8,483 МэВ) = 17,583 МэВ. Энергию связи любого ядра ученики уже могут рассчитывать, поэтому для них не представляет большого труда рассчитать энергетический выход любой ядерной реакции таким способом.
Задача 2. Определите энергию реакции 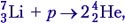
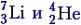
Решение. Под действием протона ядро лития разрушается, на что затрачивается энергия связи, но при этом возникают два ядра гелия и выделяется энергия Е = 2(4 ∙ 7,06 МэВ/нуклон) – 7 ∙ 5,60 МэВ/нуклон = 17,28 МэВ.
Задача 3. В ядерной реакции 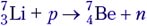
Решение. Это первый пример ядерной реакции, в которой энергия поглощается (Еп). В лабораторной системе отсчёта имеем движущийся со скоростью υ протон и покоящееся ядро лития (рис. а). После ядерной реакции нейтрон неподвижен, а ядро бериллия приобретает некоторую скорость V (рис. б).

По закону сохранения импульса, mpυ = mBeV. Зная массовое число каждой частицы, находим V = (1/7)υ. В лабораторной системе отсчёта 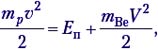
Теперь выясним, при какой минимальной энергии налетающих протонов Е′ эта реакция вообще может идти. В системе отсчёта «центр масс системы протон–ядро лития», которая движется вправо с некоторой скоростью υ′, их импульс mp(υ – υ′) – mLiυ′ = 0, откуда υ′ = 1/8 υ. Если протон обладает минимальной энергией Е′, то в данной системе отсчёта вся она поглощается и возникшие в реакции частицы не разлетаются: 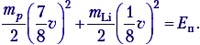
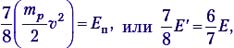
Задача 4. Если направить поток протонов на кусок льда из тяжёлой воды D2O, то при минимальной кинетической энергии протонов Е = 1,4 МэВ происходит ядерная реакция с образованием ядер 
Решение. Запишем закон сохранения импульса и закон сохранения энергии для данной реакции V:
где Еп – энергия, поглощаемая в данной реакции.
Запишем закон сохранения импульса и закон сохранения энергии для случая, когда ядра дейтерия попадают на кусок льда из обычной воды:
Задача 5. В реакции 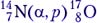
Решение. Найдём дефект массы: 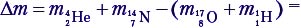
Эта реакция идёт с поглощением энергии! Еп = 1,2 МэВ.
Запишем закон сохранения импульса и закон сохранения энергии для этой реакции:
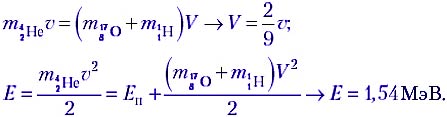
Энергии налетающей частицы вполне достаточно для того, чтобы данная реакция протекала! Полная кинетическая энергия продуктов распада Е – Еп = 6,14 МэВ.
Литература
- Джанколи Д. Физика. – М.: Мир, 1989.
- Савченко О.Я. Задачи по физике. – Новосибирск: НГУ, 1999.
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
C + O2 = CO2 + Q
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
2KNO3 → 2KNO2 + O2 – Q
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
4NH3 + 3O2 → 2N2 + 6H2O + Q
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения. Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
2Аl + 3/2О2 → Аl2О3 + 1675 кДж
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
4Аl + 3О2 → 2Аl2О3 + 3350 кДж
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
СН4 + 2О2 → СО2 + 2Н2О + 802 кДж
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
N2 + O2 → 2NО – 180 кДж
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
m (H2O)=108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
S(ромб) + O2(г) = SO2(г) + 296 кДж,
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Q = 740 кДж.
Ответ: выделится 740 кДж теплоты.
72. Энергия связи ядер. Ядерные реакции → номер 1778
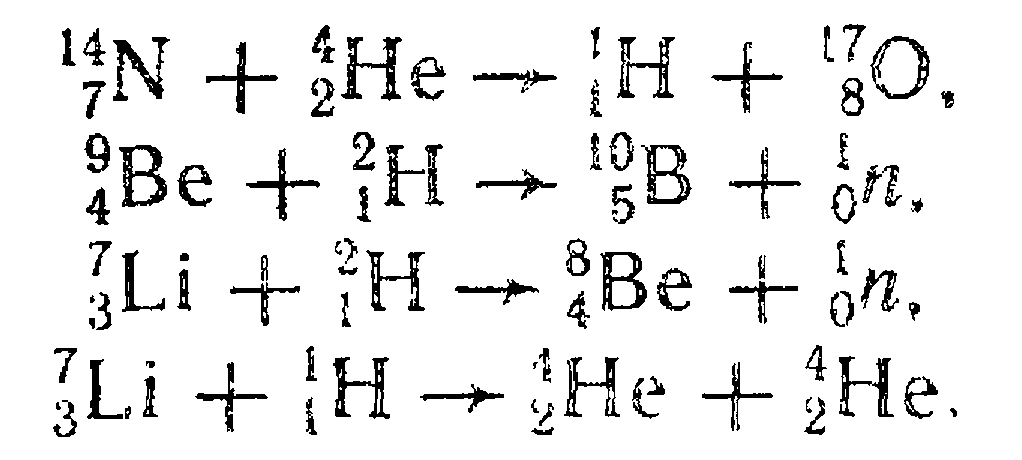
2)
Аналогично пункту 1), Е=4,35 (МэВ) 3) Е=15 МэВ; 4) Е=17,3 МэВ.